
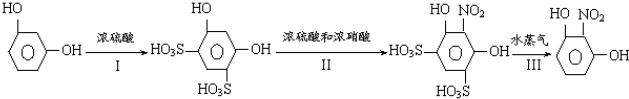

分析 (1)间苯二酚直接与硝酸、硫酸的混合溶液在加热条件下,磺酸基能取代苯环上羟基邻对位的氢,而产生副产物;
(2)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故、又能在A装置中冷却时,防止B装置处引起倒吸;
(3)步骤②中在温度较高时,硝酸会分解,同时酚在高温时容易被氧化;
(4)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质中含有硫酸根离子,证明2-硝基-1,3-苯二酚是否洗涤干净,可以通过检验洗涤滤液中是否含有硫酸根离子判断;
(5)根据产率=$\frac{实际产量}{理论产量}$×100%计算;
解答 解:(1)间苯二酚直接与硝酸、硫酸的混合溶液在加热条件下,磺酸基能取代苯环上羟基邻对位的氢,而产生副产物,所以设计I、Ⅲ两步避免副产物的产生,
故答案为:避免副产物的产生;
(2)烧瓶A中玻璃管起稳压作用,既能防止装置中压强过大引起事故、又能在A装置中冷却时,防止B装置处防止压强过小引起倒吸,
故答案为:防止压强过小引起倒吸;
(3)步骤②中在温度较高时,硝酸会分解,同时酚在高温时容易被氧化,导致产率过低,所以温度应严格控制不超过30℃,
故答案为:度较高时硝酸易分解(酚易氧化),产率过低;
(4)步骤③所得2-硝基-1,3-苯二酚中仍含少量杂质中含有硫酸根离子,证明2-硝基-1,3-苯二酚已经洗涤干净的操作为取少量洗涤液,滴加BaCl2溶液,若无沉淀产生,证明已经洗涤干净,
故答案为:取少量洗涤液,滴加BaCl2溶液,若无沉淀产生,证明已经洗涤干净;
(5)5.5g间苯二酚的物质的量为0.05mol,根据元素守恒可知,生成的2-硝基-1,3-苯二酚的质量为0.05mol×155g/mol=7.75g,产率=$\frac{实际产量}{理论产量}$×100%=$\frac{1.0}{7.75}$×100%=12.9%,
故答案为:12.9%.
点评 本题考查有机物合成实验、物质的分离与洗涤等基本操作、对实验装置的分析评价等,较好的考查学生对数据的应用、阅读获取信息的能力以及知识迁移应用,难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.12L | B. | 2.24L | C. | 4.48L | D. | 6.72L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 | |
| B. | 等物质的量的H2和CO含有的分子总数都为NA个 | |
| C. | 46 g 二氧化氮和46 g四氧化二氮含有的原子数均为3 NA | |
| D. | 在1 mol•L-1的硝酸镁溶液中含有的硝酸根离子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是( )
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示.则下列说法中不正确的是( )| A. | 还原性:I->Fe2+>Br- | |
| B. | 原混合溶液中FeBr2的物质的量为3mol | |
| C. | 线段AB表示Fe2+被氯气氧化 | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)═2:1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 溶液中可能含有 H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入 NaOH 溶液,产生白色沉淀,且产生的沉淀量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是( )
溶液中可能含有 H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种.①加入铝片,产生无色无味的气体;②加入 NaOH 溶液,产生白色沉淀,且产生的沉淀量与加入 NaOH 的物质的量之间的关系如图所示.则下列说法正确的是( )| A. | 溶液中一定不含 CO32-,可能含有 SO42-和 NO3- | |
| B. | n(H+):n(NH4+):n(Mg2+)=2:4:1 | |
| C. | 溶液中的阳离子只有 H+、Mg2+、Al3+ | |
| D. | 在滴加 NaOH 溶液物质的量为 0.5 至 0.7mol 时,发生的离子反应为:Al3++4OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
| 溶解度(g/l00gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 3种 | B. | 4种 2种 | C. | 3种 3种 | D. | 3种 2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增大亚硫酸钠粉末的量 | |
| B. | 硫酸浓度增大一倍,用量减少到原来的$\frac{1}{2}$ | |
| C. | 硫酸浓度不变,用量增大一倍 | |
| D. | 使反应在较低温度下进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com