
| c(H+)c(CH3COO-) |
| C(CH3COOH) |
| 10-7×0.005 | ||
|
| 10-9 |
| a-0.01 |
| 10-9 |
| a-0.01 |


 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
| 温度/℃ | 1538 | 1760 | 2404 |
| 平衡常数定 | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
| 时间/min | N2(mol?L-1) | 02(mol?L-1) | NO(mol?L-1) |
| 0 | 2.60 | 2.60 | 0 |
| 2 | 2.54 | 2.54 | 0.12 |
| 3 | c1 | c2 | c3 |
| 4 | c1 | c2 | c3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
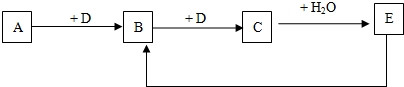
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:X>Y>Z>W |
| B、原子序数:Y>X>Z>W |
| C、原子最外层电子数:Y>X>Z>W |
| D、金属性:X<Y,还原性:W2->Z- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配位键也是一种静电作用 |
| B、配位键实质也是一种共价键 |
| C、形成配位键的电子对由成键双方原子提供 |
| D、配位键具有饱和性和方向性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.4mol?L-1 |
| B、0.3mol?L-1 |
| C、0.2mol?L-1 |
| D、0.1mol?L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com