
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用无色广口玻璃瓶保存氨水 | ||
| C. | 稀硝酸可除去试管内壁粘有的硫磺 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:多选题
| A. | 聚丙烯塑料的结构简式为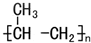 | |
| B. | 聚氯乙烯塑料单体的电子式为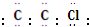 | |
| C. | 塑料购物袋的生产原料需要消耗大量木材 | |
| D. | 聚乙烯中含碳质量分数与其单体的含碳质量分数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
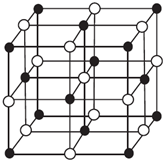 现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:
现有前四周期A、B、C、D、E、X六种元素,已知B、C、D、E、A五种非金属元素原子半径依次减小,其中B的s能级上电子总数等于p能级上电子总数的2倍.X原子的M能层上有4个未成对电子.请回答下列问题:| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 离子半径 | 熔点 | 酸性 |
| Cl- >Na+ | NaCl <C(金刚石) | H3PO4 <HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
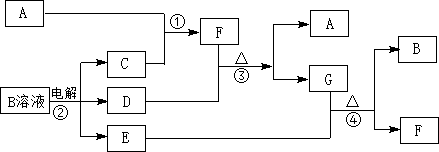 (1)写出化学式FNH3,
(1)写出化学式FNH3,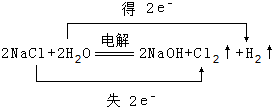 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1MgCl2溶液中的Mg2+数为NA | |
| B. | 1molNa2O2固体中含阴离子总数为2NA | |
| C. | 5g质量分数为46%的乙醇溶液中,氢原子的总数为0.6NA | |
| D. | 100mL12mol•L-1浓盐酸与足量MnO2加热反应,转移电子数为1.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22m/n mol-1 | B. | m/22n mol-1 | C. | n/32m mol-1 | D. | n/32mmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
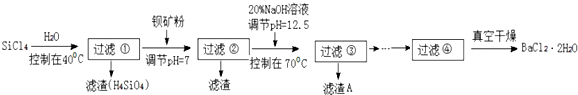
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com