
| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
分析 A、当溶液中含有的是Fe3+时,滴加氯水,再滴加KSCN溶液也会出现变红的现象;
B、NO2气体中存在平衡:2NO2?N2O4;
C、Kw只受温度的影响;
D、5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl中银元素的价态由0价升高为+1价.
解答 解:A、当溶液中含有的是Fe3+时,滴加氯水、再滴加KSCN溶液也会出现变红的现象,故先滴加氯水、再滴加KSCN溶液无法确定溶液中是Fe3+还是Fe2+,故A错误;
B、NO2气体中存在平衡:2NO2?N2O4,故标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数小于NA,故B错误;
C、Na2CO3溶液加水稀释后,溶液中氢氧根的浓度降低,故pH减小,但Kw只受温度的影响,温度不变,故pH不变,故C错误;
D、5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl中银元素的价态由0价升高为+1价,故反应转移2mol电子,生成1molNa2Mn5O10,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{b}$ | B. | $\frac{a}{2b}$ | C. | $\frac{a}{a+2b}$ | D. | $\frac{b}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
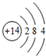 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 稀盐酸可除去烧瓶内残留的MnO2 | B. | 可用无色广口玻璃瓶保存氨水 | ||
| C. | 稀硝酸可除去试管内壁粘有的硫磺 | D. | 煮沸自来水可除去其中的Ca(HCO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2•H2O2 | 白色晶体 | 45℃ | 75-85℃ | 易溶于水、有机溶剂 |
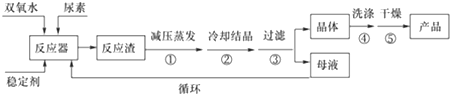
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )
如图表示两项实验:①在燃着的蜡烛甲、乙上倒扣一只玻璃圆筒;②往放有燃着的蜡烛丙、丁的烧杯中慢慢倾入CO2气体.在两项实验中先熄灭的蜡烛分别是( )| A. | 甲、丙 | B. | 乙、丙 | C. | 甲、丁 | D. | 乙、丁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com