
| A. | 加入稀盐酸产生无色气体,将该气体通入澄清石灰水中变浑浊,则一定有CO32- | |
| B. | 加入烧碱溶液并加热,产生的气体能使湿润的红色石蕊试纸变蓝,则一定有 NH4+ | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则一定有SO42- | |
| D. | 加入Na2CO3 溶液产生白色沉淀,再加盐酸,白色沉淀消失,则一定有Ca2+ |
分析 A.可能含有HCO3-;
B.能使湿润的红色石蕊试纸变蓝的气体为氨气;
C.可能生成AgCl沉淀;
D.生成的沉淀不一定为CaCO3.
解答 解:A.向某溶液中加稀盐酸,将产生的无色气体通入澄清石灰水中,石灰水变浑浊,该气体可能为二氧化硫或二氧化碳,原溶液中可能含有SO32-或HSO3-、HCO3-,故A错误;
B.向某溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,该气体为氨气,则原溶液中一定存在NH4+,故B正确;
C.溶液不一定含有硫酸根,也可能含有银离子,形成氯化银白色沉淀,故C错误;
D.碳酸钠能与含可溶性钙离子或钡离子的物质结合生成沉淀,故D错误;
故选B.
点评 本题考查了常见离子的检验方法,题目难度中等,明确常见离子的性质为解答关键,注意掌握常见离子的检验方法,注意检验离子存在时,需要排除干扰,确保检验方案的严密性,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
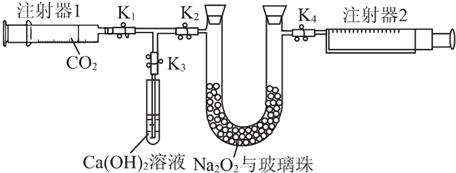
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 检验溶液中是否含有Fe2+的方法是先滴加氯水,再滴加KSCN溶液 | |
| B. | 标准状况下,将11.2LNO2和11.2LN2O4的混合,所得化合物所含分子数为NA | |
| C. | Na2CO3溶液加水稀释后,恢复至原温度,溶液的pH和Kw均减小 | |
| D. | 某电池的总反应为5MnO2+2Ag+2NaCl═Na2Mn5O10+2AgCl,每生成lmolNa2Mn5O10转移电子数2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: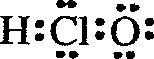 | B. | 硫原子的价电子排布式:3s23p4 | ||
| C. | 氮化硅的分子式:Si4N3 | D. | N原子的电子排布图为: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22m/n mol-1 | B. | m/22n mol-1 | C. | n/32m mol-1 | D. | n/32mmol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

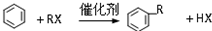 A具有和苯相似的性质.
A具有和苯相似的性质. 2HCHO+2H2O;
2HCHO+2H2O;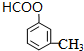 、
、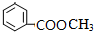 ;
;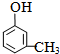 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加石蕊试液显红色的溶液:Fe3+、SO42-、C1-、SCN- | |
| B. | c(Al3+)=0.5mol•L的溶液中:Na+、K+、HCO3-、SO42- | |
| C. | $\frac{c(O{H}^{-})}{c({H}^{+})}$=10 的溶液中:SO32-、NH4+、NO3-、K+ | |
| D. | 滴加甲基橙试液呈红色的溶液:NH4+、Ba2+、Al3+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 500℃左右的温度比室温更有利于合成氨反应N2(g)+3H2(g)?2NH3(g)△H<0 | |
| B. | 在恒容密闭容器中充入一定量NO2建立2NO2(g)═N2O4(g)△H<0 平衡后,升高温度,体系颜色加深 | |
| C. | 向水中投入金属Na,最终溶液呈碱性 | |
| D. | FeCl3和KSCN的混合溶液中加入FeCl3固体,溶液颜色加深 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com