
【题目】氯元素的单质及其化合物用途广泛。某兴趣小组拟制备氯气并验证其一系列性质。
I.(查阅资料)
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂
II.(性质验证)
实验装置如图1所示(省略夹持装置)
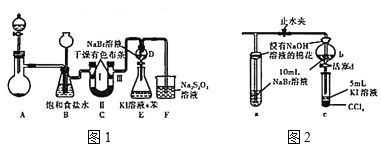
(1)装置A中盛放固体试剂的仪器是____;若分别用KMnO4、Ca(ClO)2、KClO3固体与足量的浓盐酸反应,则产生等量氯气转移的电子数之比为____。
(2)装置C中II处所加的试剂可以是____(填下列字母编号)
A.碱石灰 B.浓硫酸 C.硅酸 D.无水氯化钙
(3)装置B的作用有:除去氯气中的氯化氢、______、_____。
(4)不考虑Br2的挥发,检验F溶液中Cl-需要的试剂有_______。
III.(探究和反思)
图一中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为图2装置,实验操作步骤如下:
①打开止水夹,缓缓通入氯气;②当a和b中的溶液都变为黄色时,夹紧止水夹;
③当a中溶液由黄色变为棕色时,停止通氯气;④…
(5)设计步骤③的目的是______。
(6)还能作为氯、溴、碘非金属性递变规律判断依据的是_____(填下列字母编号)
A.Cl2、Br2、I2的熔点 B.HCl、HBr、HI的酸性
C.HCl、HBr、HI的热稳定性 D.HCl、HBr、HI的还原性
【答案】蒸馏烧瓶 6:3:5 CD 安全瓶 观察气泡调节气流 稀HNO3、Ba(NO3)2、AgNO3 对比证明b中Cl2未过量 CD
【解析】
(1)根据仪器的构造可知,装置A中盛放固体试剂的仪器是蒸馏烧瓶;若分别用KMnO4、Ca(ClO)2、KClO3固体与足量的浓盐酸反应,反应的离子方程式分别为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O、ClO-+2H++Cl-=Cl2↑+H2O、ClO3-+6H++5Cl-=3Cl2↑+3H2O,则产生等量氯气(假设均是1mol)转移的电子数之比为2:1:5/3=6:3:5;
(2)装置C中II处所加的试剂用于干燥氯气,且为固体,不能是碱性干燥剂,否则会吸收氯气,故可以是硅酸或无水氯化钙,答案选CD;
(3)生成的氯气中混有氯化氢,则装置B的作用有:除去氯气中的氯化氢并作安全瓶,观察气泡调节气流等作用;
(4)不考虑Br2的挥发,检验F溶液中Cl-,必须先用足量Ba(NO3)2将硫酸根离子沉淀,再用稀硝酸酸化,再用硝酸银检验溴离子,故需要的试剂有稀HNO3、Ba(NO3)2、AgNO3;
(5)设计步骤③的目的是对比实验思想,即目的是对比证明b中Cl2未过量;
(6)A.Cl2、Br2、I2的熔点与分子间作用力有关,与非金属性无关,选项A错误;
B.酸性为HI>HBr>HCl,但非金属性Cl2>Br2>I2,不是非金属的最高价氧化物的水化物,不能根据HCl、HBr、HI的酸性判断非金属性,选项B错误;
C.氢化物的稳定性越强,则非金属性越强,可以根据HCl、HBr、HI的热稳定性判断非金属性,选项C正确;
D.单质的氧化性越强,则非金属性越强,其氢化物的还原性越弱,可以根据HCl、HBr、HI的还原性来判断非金属性,选项D正确;
答案选CD。


科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
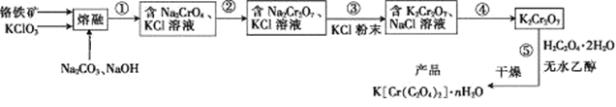
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
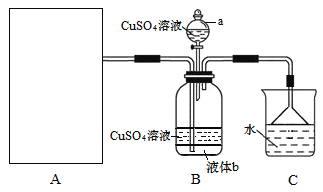
回答下列问题:
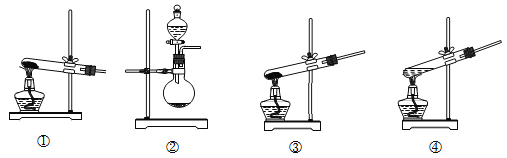
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
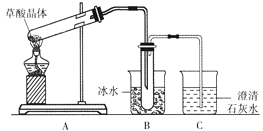
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种废料的主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物,由该废料制备的纯度较高的氢氧化镍,工艺流程如下,已知常温下Ksp[Ni(OH)2]=1.0×10-15,则下列说法错误的是( )
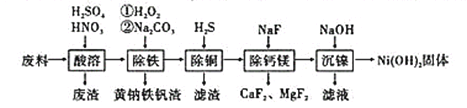
A. 废渣中含有二氧化硅和硫酸钙
B. 加热煮沸可以提高除铁效率
C. 除铜过程中,溶液酸性增强
D. “沉镍”过程中为了将镍沉淀完全,需要调节pH>9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰硫酸(NOSO4H)主要用于染料、医药等工业。实验室用如图装置(夹持装置略)制取少量的NOSO4H,并检验产品纯度。已知:NOSO4H遇水水解,但溶于浓硫酸而不分解。

(1)利用装置A制取SO2,下列最适宜的试剂是_____(填下列字母编号)
A.Na2SO3固体和20%硝酸 B.Na2SO3固体和20%硫酸
C.Na2SO3固体和70%硫酸 D.Na2SO3固体和18.4mol/L硫酸
(2)装置B中浓HNO3和SO2在浓H2SO4作用下反应制得NOSO4H。
①为了控制通入SO2的速率,可以采取的措施是_______。
②该反应必须维持体系温度不低于20℃。若温度过高,产率降低的可能原因是____。
③开始反应缓慢,待生成少量NOSO4H后,温度变化不大,但反应速率明显加快,其原因可能是______。
(3)在实验装置存在可能导致NOSO4H产量降低的缺陷是______。
(4)测定NOSO4H的纯度
准确称取1.337 g产品加入250 mL碘量瓶中,加入0.1000mol/L、60.00 mL的KMnO4标准溶液和10 mL 25%H2SO4溶液,然后摇匀。用0.2500 mol/L草酸钠标准溶液滴定,消耗草酸钠溶液的体积为20.00 mL。
已知:2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
①配平:__MnO4-+___C2O42-+______=___Mn2++____+__H2O
②亚硝酰硫酸的纯度=___%(计算结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5 L某浓度的NaCl溶液中含有0.5 mol NaCl,下列对该溶液的说法中,不正确的是
A. 该溶液溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5 g NaCl
C. 配制100 mL该溶液需用5.85 g NaCl
D. 量取100 mL该溶液倒入烧杯中,烧杯中的NaCl物质的量为0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁是重要的亚铁盐,在农业上用作农药,主要治小麦黑穗病,还可以用作除草剂;在工业上用于染色、制造蓝黑墨水和木材防腐等。
(1)新制的绿矾(FeSO4·7H2O)是浅绿色的,但在空气中极易变成黄色或铁锈色的碱式硫酸铁[Fe(OH)SO4],写出该反应的化学方程式:______。
(2)已知FeSO4在不同条件下分解得到产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2;SO3熔点是16.8℃,沸点是44.8℃。
某研究性学习小组拟用下列装置进行实验探究“在加热条件下FeSO4的分解产物”。
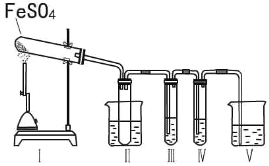
上述装置Ⅲ和Ⅳ用来检验气体产物。试回答下列问题:
①Ⅱ装置烧杯中水的温度应控制在___(选填“0℃、25℃、50℃”),装置Ⅱ的作用是___________。
②装置Ⅲ中的试剂可以是________(选填序号,下同),现象是 ,则证明气体产物中含有SO3;装置Ⅳ中的试剂可以是__________________。
A.2mol/LNa2CO3溶液 |
B.品红溶液 |
C.0.5mol/L BaCl2溶液 |
D.0.5mol/LBa(NO3)2 |
E.0.01mol/L KMnO4溶液
F.淀粉碘化钾溶液
③装置V中试剂为NaOH溶液,发生反应的离子方程式为_____________。
④为了检验固体产物成分,取反应后的固体于试管中,加稀硫酸溶解,将所得溶液分成两份,进行如下实验:
操作步骤 | 预期实验现象 | 预期实验结论 |
向其中一份溶液中加入_______________ | _____________________ | 固体中含有Fe2O3 |
向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液 | 产生蓝色沉淀 | ______________ |
⑤若用22.8g FeSO4固体做实验,完全分解后,得到11.2g固体,其中Fe2O3的质量分数=______(精确到0.1%)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com