
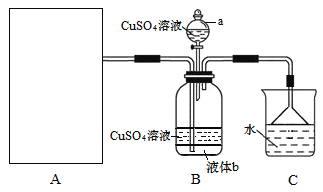
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
回答下列问题:
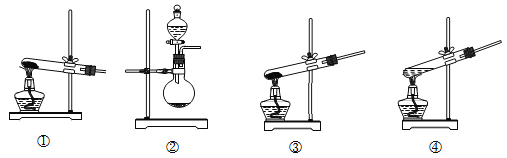
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
【答案】①②④ 分液漏斗 CCl4 防止倒吸 乙醇 淀粉溶液 滴入最后一滴,溶液蓝色褪去且半分钟不复色 98.4%或0.984
【解析】
(1)根据制取氨气使用的试剂的状态确定装置图的使用;
(2)根据仪器结构判断仪器名称,根据液体b密度比水大,与水互不相溶的性质分析物质,结合氨气极容易溶于水分析其作用;
(3)根据硫酸四氨合铜晶体为深蓝色晶体,溶于水,不溶于乙醇分析使用的物质;
(4)①根据I2遇淀粉溶液变为蓝色,选择使用的指示剂,I2会发生反应I2+2S2O32-=S4O62-+2I-,反应完全蓝色消去判断滴定终点;
②用关系式法找出Cu2+与S2O32-的关系,根据消耗的S2O32-的物质的量计算出Cu2+的物质的量及Cu(NH3)4]SO4·H2O的质量,进而可得其纯度。
(1)在实验室中,若用固体NH4Cl与Ca(OH)2混合加热制取氨气,应该选择①装置;若向CaO固体中加入浓氨水制取氨气,应该选择选项②;若用浓氨水直接加热制取氨气,则选择装置④;故合理选项是①②④;
(2)有仪器a结构可知该仪器名称为分液漏斗,由于液体b密度比水大,与水互不相溶,可确定该物质是四氯化碳,液体b的化学式CCl4;装置A是制取氨气,在装置B中与CuSO4溶于反应制取硫酸四氨合铜晶体,由于氨气极容易溶于水,为了充分吸收氨气,同时防止倒吸现象的发生,使用了CCl4,因此CCl4的作用是防止倒吸;
(3)由于硫酸四氨合铜晶体为深蓝色晶体,溶于水,不溶于乙醇,能在热水中分解,所以实验时可向所得溶液中加入乙醇来获得晶体;
(4)①Cu2+与I-反应产生I2,I2遇淀粉溶液变为蓝色,故可选择淀粉溶液为指示剂,Cu2+与I-反应产生I2,向该溶液中滴加Na2S2O3标准溶液,I2会发生反应I2+2S2O32-=S4O62-+2I-,当I2反应完全时,溶液的蓝色消去,据此判断滴定终点。实验现象是:滴入最后一滴,溶液蓝色褪去且半分钟不复色;
②Cu2+与过量I-作用,生成I2和CuI,反应方程式为:2Cu2++4I-=2CuI↓+I2,向该溶液中滴加Na2S2O3标准溶液,I2会发生反应I2+2S2O32-=S4O62-+2I-,可得关系式2Cu2+ ~I2~ 2S2O32-,反应消耗的S2O32-的物质的量n(S2O32-)=0.050mol/L×0.016L×![]() =0.004mol,则溶液中含有Cu2+的物质的量n(Cu2+)= n(S2O32-)=0.004mol,根据Cu元素守恒可知反应产生的[Cu(NH3)4]SO4·H2O]的物质的量是0.004mol,其质量是m{[Cu(NH3)4]SO4·H2O}=0.004mol×246g/mol=0.984g,因此该物质的纯度是(0.984g÷1.0g)×100%=98.4%=0.984。
=0.004mol,则溶液中含有Cu2+的物质的量n(Cu2+)= n(S2O32-)=0.004mol,根据Cu元素守恒可知反应产生的[Cu(NH3)4]SO4·H2O]的物质的量是0.004mol,其质量是m{[Cu(NH3)4]SO4·H2O}=0.004mol×246g/mol=0.984g,因此该物质的纯度是(0.984g÷1.0g)×100%=98.4%=0.984。


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )

A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2F2+2H2O=4HF+O2↑;②AlCl3+3NaHCO3=Al(OH)3↓+3NaCl+3CO2↑ ;③2Na+2H2O=2NaOH+H2↑;④SO2+H2O=H2SO3⑤SO2+Cl2+2H2O=H2SO4+2HCl;⑥NaH+H2O=NaOH+H2↑;⑦CO+H2O![]() CO2+H2;⑧3NO2+H2O = 2HNO3+NO
CO2+H2;⑧3NO2+H2O = 2HNO3+NO
(1)上述反应中不属于氧化还原反应的有(填序号,下同)_____________
(2)H2O被氧化的是_____________;属于氧化还原反应,但H2O既不被氧化,也不被还原的是_____________。
(3)写出⑤的离子反应方程式_____________。
(4)用双线桥法表示反应⑧中电子转移的方向和数目,并指出氧化产物和还原产物。双线桥法:_____________;氧化产物:_____________;还原产物:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸亚铁锂(LiIFePO4)电池(如图所示)是新能源汽车的动力电池之一。M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池的总反应为LixC6+Li1-xFePO4![]() LiFePO4+6C。下列说法正确的是
LiFePO4+6C。下列说法正确的是
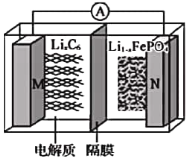
A. 放电时,Li+向M电极移动
B. 充电时电路中每通过0.5mol电子,就有36g碳和金属锂复合在一起
C. 放电时,M电极的电极反应为![]()
D. 充电时,N电极的电极反应为LiFePO4-xe-=xLi++Li1-xFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半导体工业会产生含氢氟酸的废水。回答下列问题:
(1)为了测定某含氢氟酸的废水中HF浓度,量取25.00mL废水,滴入2~3滴酚酞试液,用0.0100molL-1NaOH标准溶液滴定,用去27.00mL。滴定终点的判断方法是____________;废水中的c(HF)=__________________molL-1 (精确到0.0001)。
(2)用石灰乳处理含氢氟酸的废水时,会得到含氟底泥(主要含CaF2、CaCO3、CaSO4)。含氟底泥可用于制取氟化钙,其生产流程如下:
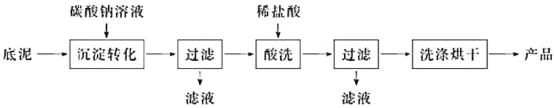
已知:氟化钙难溶于水,微溶于无机酸。
①“沉淀转化”的目的是将CaSO4转化为CaCO3。从平衡移动的角度分析,沉淀能够转化的原理是____________________________。
②最终得到的产品质量比底泥中CaF2的质量少,其原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
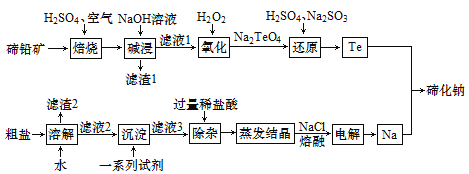
【题目】碲化钠(Na2Te)可用作有机合成试剂及缩合反应中的催化剂。以碲铅矿(主要成分为PbTe)和粗盐(含CaCl2、MgCl2及一些硫酸盐、泥沙)为原料制备碲化钠的工艺流程如下:
回答下列问题:
(1)Na2TeO4中Te的化合价为___。
(2)“沉淀”步骤中一系列试剂均过量,这些试剂依次包括_____(填化学式)和NaOH。
(3)“蒸发结晶”时用到的主要仪器有铁架台(带铁圈)、酒精灯、坩埚钳、_____等。
(4)已知“焙烧”后,碲主要以TeO2形式存在,“焙烧”反应的化学方程式为____。
(5)依据“氧化”“还原”两步反应可判知Na2TeO4、H2O2和Na2SO4氧化性由强到弱的顺序为___;“还原”步骤中,还原剂与氧化剂的物质的量比为_______。
(6)若制得8.7kg碲化钠,理论上电解产生标准状况下氯气的体积为______升。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与所通入CO2的体积关系如图所示。下列关于整个反应过程中的说法错误的是( )
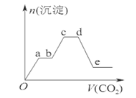
A. e点溶液中c(HCO3-)>c(K+)
B. bc段反应的离子方程式是AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-
C. d点溶液中c(K+)= c(H2CO3)+c(HCO3-)+c(CO32-)
D. Oa段与de段所消耗CO2的体积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素的单质及其化合物用途广泛。某兴趣小组拟制备氯气并验证其一系列性质。
I.(查阅资料)
①当溴水浓度较小时,溶液颜色与氯水相似也呈黄色
②硫代硫酸钠(Na2S2O3)溶液在工业上可作为脱氯剂
II.(性质验证)
实验装置如图1所示(省略夹持装置)
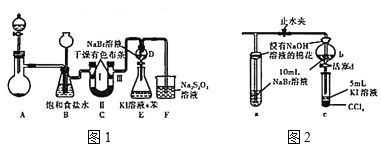
(1)装置A中盛放固体试剂的仪器是____;若分别用KMnO4、Ca(ClO)2、KClO3固体与足量的浓盐酸反应,则产生等量氯气转移的电子数之比为____。
(2)装置C中II处所加的试剂可以是____(填下列字母编号)
A.碱石灰 B.浓硫酸 C.硅酸 D.无水氯化钙
(3)装置B的作用有:除去氯气中的氯化氢、______、_____。
(4)不考虑Br2的挥发,检验F溶液中Cl-需要的试剂有_______。
III.(探究和反思)
图一中设计装置D、E的目的是比较氯、溴、碘的非金属性,有同学认为该设计不能达到实验目的。该组的同学思考后将上述D、E、F装置改为图2装置,实验操作步骤如下:
①打开止水夹,缓缓通入氯气;②当a和b中的溶液都变为黄色时,夹紧止水夹;
③当a中溶液由黄色变为棕色时,停止通氯气;④…
(5)设计步骤③的目的是______。
(6)还能作为氯、溴、碘非金属性递变规律判断依据的是_____(填下列字母编号)
A.Cl2、Br2、I2的熔点 B.HCl、HBr、HI的酸性
C.HCl、HBr、HI的热稳定性 D.HCl、HBr、HI的还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设计的CO2资源化利用的装置如图所示(电解质溶液为稀H2SO4),下列说法错误的是
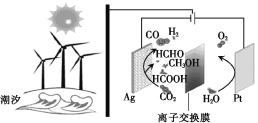
A.该离子交换膜为质子交换膜
B.Ag极上的电势比Pt极上的高
C.电路中每流过4 mol电子,阳极区质量减少36 g
D.太阳能、风能及潮汐能均是可再生能源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com