
【题目】有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如图实验,从实验可以判断:( )

A.该固体粉末中一定不含有BaCl2
B.该固体粉末中一定含有KNO3
C.它的组成可能是CaCO3、BaCl2、Na2SO4
D.它的组成一定是CaCO3、Na2SO4、KNO3
【答案】B
【解析】
固体粉末CaCO3、Na2SO4、KNO3、BaCl2、CuSO4溶于水有沉淀、得到无色溶液,则能排除CuSO4,因为CuSO4溶于水显蓝色;难溶物溶于稀盐酸,说明一定含有碳酸钙,硫酸钠和氯化钡不会同时存在,还有一种物质就是硝酸钾。
A. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故A错误;
B. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故B正确;
C. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故C错误;
D. 由以上分析可知,一定含有CaCO3、KNO3,硫酸钠和氯化钡不会同时存在,则组成可能为CaCO3、Na2SO4、KNO3或CaCO3、KNO3、BaCl2,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】吡喹酮(H)是一种治疗血吸虫病的药物,合成路线如下图所示:
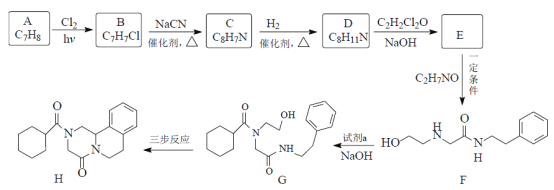
已知:i ![]() ii
ii
(1)下列说法正确的是______________。
A.1molC最多消耗2molH2 B.可以用双缩脲鉴别H与F
C.化合物E、F均可发生消去反应 D.化合物H的分子式为C19H24N2O2
(2)试剂a的结构简式______________,E→F的反应类型为______________。
(3)D→E的化学方程式是__________________________________________。
(4)写出同时符合下列条件的C的所有同分异构体的结构简式______________。
①分子中有苯环而且是苯环的邻位二取代物;
②1H-NMR谱表明分子中有6种氢原子;IR谱显示存在碳氮双键(C=N)。
(5)G→H三步反应依次为氧化、加成、取代反应,则G→H的合成路线为:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.惰性电极电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.钢铁吸氧腐蚀中的正极反应:4OH-- 4e-=2H2O+O2 ↑
C.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为____。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为____。
下列反应中的氨与氨氧化法中的氨作用相同的是___。
A.2Na+2NH3=2NaNH2+H2↑ B.2NH3+3CuO=3Cu+N2+3H2O
C.4NH3+6NO=5N2+6H2O D.HNO3+NH3=NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣=NO2-+NO3-+H2O和NO+NO2+2OH﹣=___+H2O(配平该方程式)。
(3)向27.2gCu和Cu2O的混合物中加入某浓度的稀HNO3500mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1L1mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2g。
①Cu与稀HNO3反应的离子方程式为________。
②Cu与Cu2O 的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25g·mL-1,质量分数36.5%的浓盐酸配制0.1mol·L-1的盐酸240mL,请回答下列问题:
(1)浓盐酸的物质的量浓度为_______。
(2)配制240 mL0.1mol·L-1的盐酸应选用_______mL的容量瓶,需要量取浓盐酸体积为_______mL。
(3)定容时,除了烧杯、玻璃棒、容量瓶外,还需要的玻璃仪器是_______。
(4)正确的操作顺序是________(填序号)
①用胶头滴管逐滴加水,使溶液凹液面恰好与容量瓶刻度线相切
②向容量瓶中加水至液面接近瓶颈上的刻度线1-2cm处
③根据计算,用量筒称取一定体积的浓盐酸
④将容量瓶盖紧,振荡,摇匀
⑤将浓盐酸倒入烧杯中加水稀释,并不断用玻璃棒搅拌,静置待其冷却
⑥将溶液用玻璃棒引流注入查漏过的容量瓶中
⑦少量水洗涤烧杯及玻璃棒2至3次,并将每次的洗涤液也注入容量瓶中
(5)下列操作对所配溶液的浓度大小有何影响 (填“偏大”、“偏小”或“无影响”)。
①定容时,俯视刻度线,浓度_________;
②定容摇匀后发现溶液凹面低于刻度线,加水至刻度线,浓度________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在500 mL KNO3和Cu(NO3)2的混合溶液中,c(NO3-)=6 mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是
A. 电解得到的Cu的物质的量为0.5 mol
B. 向电解后的溶液中加入98 g的Cu(OH)2可恢复为原溶液
C. 原混合溶液中c(K+)=4 mol/L
D. 电解后溶液中c(H+)=2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿(含FeO·Cr2O3、Al2O3、SiO2等)为原料制备二草酸铬钾的实验步骤如下:
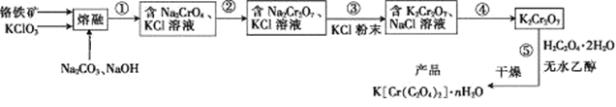
回答下列问题:
(1)若“熔融”在坩埚中进行,其材质可以是____(填“铁”、“陶瓷”或“SiO2”)。
(2) FeO·Cr2O3与KClO3及Na2CO3发生反应,生成Fe2O3、KCl、Na2CrO4和CO2的化学方程式为____________________________。
(3)熔融后的固体中含Na2CrO4、Fe2O3、Na2SiO3、NaAlO2、KCl等, 步骤①包含两次过滤操作:一是水浸后过滤;二是调节所得滤液pH为7~8,加热煮沸半小时,趁热过滤。第一次过滤滤渣中的主要成分为______,第二次过滤滤渣的主要成分为_________。
(4)步骤②需加入酸,则加入稀硫酸时发生反应的离子方程式为___________。
(5)步骤④包含的具体操作有_____、_____,过滤、洗涤,再经干燥得到K2Cr2O7晶体。(有关物质的溶解度曲线如图所示)

(6)已知K[Cr(C2O4)2]的相对分子质量为267。采用热重分析法测定K[Cr(C2O4)2]·nH2O样品所含结晶水数目,将样品加热到80 ℃时,失掉全部结晶水,失重16.8%。K[Cr(C2O4)2]·nH2O晶体中n=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸四氨合铜晶体{[Cu(NH3)4]SO4·H2O}为深蓝色晶体,溶于水,不溶于乙醇,主要用作印染剂、杀虫剂及制备某些含铜的化合物。某实验小组拟制备氨气,并通入到硫酸铜溶液中制备硫酸四氨合铜,装置如下:
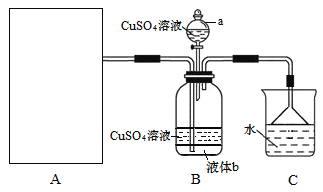
回答下列问题:
(1)装置A为制备氨气的实验装置,下列装置中可选用的有______(填标号)。
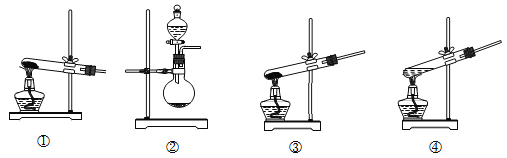
(2)装置a的名称为______;已知液体b与CuSO4溶液互不相溶,是常用的有机溶剂,则液体b的化学式为_____,作用是______。
(3)由于硫酸四氨合铜晶体能在热水中分解,实验时可向所得溶液中加入______来获得晶体。
(4)硫酸四氨合铜晶体中铜含量的测定可用碘量法。在微酸性溶液中(pH=3~4),Cu2+与过量I-作用,生成I2和CuI(不溶于水也不溶于非氧化性酸),生成的I2用Na2S2O3标准溶液滴定(已知滴定反应为:I2+2S2O32-=S4O62-+2I-)。
①滴定过程中使用的指示剂为______,滴定终点的现象为______。
②准确称取1.00g产品,配制成100mL溶液。取20mL该溶液,用0.050mol/LNa2S2O3标准溶液进行滴定,消耗标准溶液16.00mL,计算产品纯度为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com