
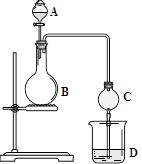
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源:不详 题型:单选题
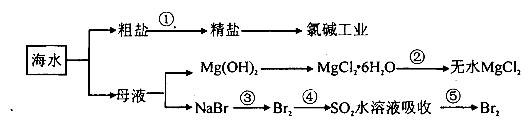
| A.第①步除去粗盐SO42-、Ca2+、Mg2+、Fe3+等杂质离子,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
B.将第②步结晶出的MgCl2 6H2O在空气中加热分解制备无水MgCl2 6H2O在空气中加热分解制备无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.电解饱和食盐水时,在阴极区生成NaOH |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.将58.5g NaCl溶于1L水中可得1L 1.00mol·L-1 NaCl溶液 |
| B.溶液定容时仰视容量瓶的刻度线,所得溶液的浓度偏大 |
| C.定容摇匀后发现液面低于刻度线,需再加水至刻度线 |
| D.容量瓶中原有少量的蒸馏水,不影响配制溶液的浓度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶液定容时俯视刻度线 |
| B.在空气中称量NaOH固体所用时间过长 |
| C.没有将洗涤液转移入容量瓶 |
| D.容量瓶洗涤后未作干燥处理即进行配制 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 完成下列填空:
完成下列填空:| A.定容摇匀后发现液面低于刻度线 |
| B.定容时俯视容量瓶的刻度线 |
| C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
| D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.钠保存在煤油中 |
| B.用棕色试剂瓶盛放新制的氯 |
| C.用带玻璃塞的试剂瓶盛放NaOH溶液 |
| D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.未冷却即转移、定容 |
| B.未洗烧杯及玻璃棒 |
| C.定容时俯视刻度线观察液面 |
| D.容量瓶中原有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
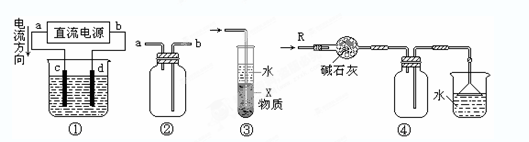
| A.装置①中,c为阳极、d为阴极 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体,且从a口进气 |
| C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸 |
| D.装置④可用于干燥、收集氨气,并吸收多余的氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com