
 完成下列填空:
完成下列填空:| A.定容摇匀后发现液面低于刻度线 |
| B.定容时俯视容量瓶的刻度线 |
| C.将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作 |
| D.如果加水超过了刻度线,取出少量水使液面恰好到刻度线 |
 =50ml。根据cB=
=50ml。根据cB=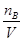 可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此可以判断。A、定容摇匀后发现液面低于刻度线属于正确现象,浓度不变;B、定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积减少,浓度偏高;C、将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作,则溶质的物质的量减少,测定结果偏低;D、如果加水超过了刻度线,取出少量水使液面恰好到刻度线,则导致溶质的物质的量减少,测定结果偏低,因此正确的答案选CD。
可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量nB和溶液的体积V引起的。误差分析时,关键要看配制过程中引起n和V怎样的变化。在配制一定物质的量浓度溶液时,若nB比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若nB比理论值大,或V比理论值小时,都会使所配溶液浓度偏大,据此可以判断。A、定容摇匀后发现液面低于刻度线属于正确现象,浓度不变;B、定容时俯视容量瓶的刻度线,则容量瓶中溶液的体积减少,浓度偏高;C、将溶液转入容量瓶后,没有洗涤烧杯和玻璃棒,就转入定容操作,则溶质的物质的量减少,测定结果偏低;D、如果加水超过了刻度线,取出少量水使液面恰好到刻度线,则导致溶质的物质的量减少,测定结果偏低,因此正确的答案选CD。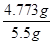 ×100%=86.78%。碳酸钙不溶于水是相对的,不可能绝对不溶。由于在洗涤时,有少量的碳酸钙溶解,从而导致测定结果偏低。
×100%=86.78%。碳酸钙不溶于水是相对的,不可能绝对不溶。由于在洗涤时,有少量的碳酸钙溶解,从而导致测定结果偏低。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源:不详 题型:单选题

| A.实验Ⅰ:液体分层,下层呈无色 |
| B.实验Ⅱ:烧杯中先出现白色沉淀,后溶解 |
| C.实验Ⅲ:试管中立刻出现红色沉淀 |
| D.实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验次序 | 温度(℃) | 冷却后剩余固体的质量(g) |
| 1 | 102 | 6.848 |
| 2 | 113 | 5.696 |
| 3 | 258 | 5.120 |
| 4 | 570 | 2.560 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.bacd | B.abcd | C.adbc | D.dabc |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
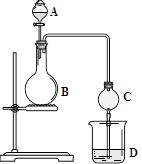
| A.证明碳酸比苯酚的酸性强 | B.证明氯气的氧化性比溴强 |
| C.用乙醇制备并检验乙烯 | D.制备并收集乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| A.分液漏斗、滴定管和容量瓶使用前必须检查是否漏水 |
| B.将碘水倒入分液漏斗,再加适量乙醇,充分振荡、静置,可从碘水中萃取碘 |
| C.洁净的铁钉在食盐水中浸泡一段时间,铁钉上有气泡,说明铁发生了析氢腐蚀 |
| D.铁丝在氯气中剧烈燃烧,火星四射,生成黑色固体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不慎将苯酚沾到皮肤上,应立即用酒精洗涤 |
| B.一氧化碳中毒后,应尽快将中毒者抬到空气流通处 |
| C.不慎将浓硫酸沾到皮肤上,应立即用氢氧化钠溶液洗涤 |
| D.解救Cu2+、Hg2+等重金属盐中毒的病人,可让病人服用大量牛奶或豆浆 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com