
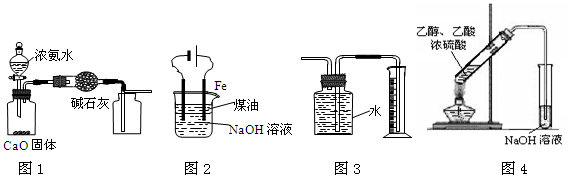
| A.用图1装置制取并收集干燥纯净的NH3 |
| B.用图2装置实验室制备Fe(OH)2 |
| C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积 |
| D.装置4可用于实验室制取乙酸乙酯 |
科目:高中化学 来源:不详 题型:问答题
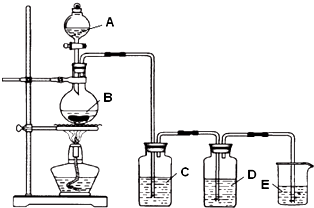
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.实验室制取乙烯时必须将温度计的水银球插入反应液中,以控制反应液的温度 |
| B.将溴乙烷和NaOH溶液共热后,再滴加AgNO3溶液可检验其中的溴元素 |
| C.向2mL2%硝酸银溶液中滴加稀氨水至产生的沉淀恰好溶解即得银氨溶液 |
| D.除去乙酸乙酯中混有少量乙酸:加入乙醇和浓硫酸,加热、静置、分液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
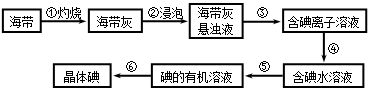
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
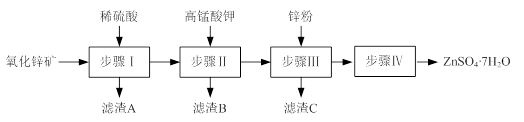
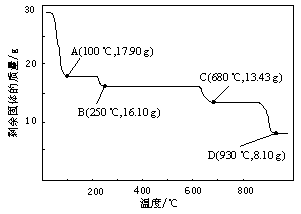
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
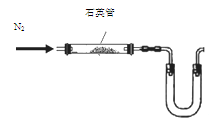
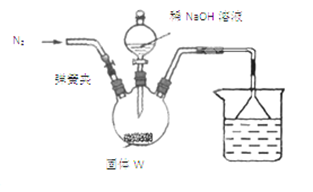
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| | |
| | 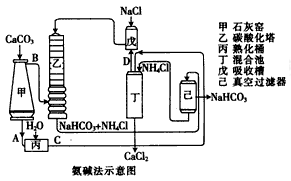 |
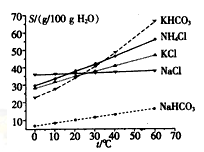
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com