
0.80gCuSO4��5H2O��Ʒ������ˮ���̵��������ߣ���Ʒ�������¶ȱ仯�����ߣ�����ͼ��ʾ��
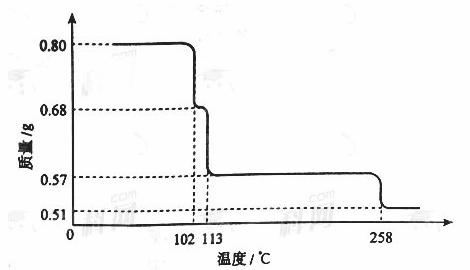
��ش��������⣺
��1����ȷ��200��ʱ�������ʵĻ�ѧʽ______________��Ҫ��д���ƶϹ��̣���
��2��ȡ270��������Ʒ����570�����յõ�����Ҫ�����Ǻ�ɫ��ĩ��һ�����������壬�÷�Ӧ�Ļ�ѧ����ʽΪ______________���Ѹú�ɫ��ĩ�ܽ���ϡ�����У���Ũ������ȴ���о����������þ���Ļ�ѧʽΪ_________������ڵ�����¶���_____________��
��3������������������ˮ��Ӧ����һ�ֻ�����û������Ũ��Һ��Cu�ڼ���ʱ������Ӧ�Ļ�ѧ����ʽΪ________________��
��4����0.10mol��L-1����ͭ��Һ�м�����������ϡ��Һ��ֽ��裬��dz��ɫ������ͭ�������ɣ�����Һ��pH=8ʱ��c��Cu2+��=________________m ol��L-1��Kap[Cu��OH��2]=2.2��10-20��������0.1mol��L-1����ͭ��Һ��ͨ�����H2S���壬ʹCu2+��ȫ����ΪCuS����ʱ��Һ�е�H+Ũ����_______________mol��L-1��
ol��L-1��Kap[Cu��OH��2]=2.2��10-20��������0.1mol��L-1����ͭ��Һ��ͨ�����H2S���壬ʹCu2+��ȫ����ΪCuS����ʱ��Һ�е�H+Ũ����_______________mol��L-1��

����������1��0.80gCuSO4��5H2O�к���CuSO4������Ϊ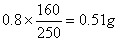 ����ͼ���֪���¶����ߵ�102����ʱCuSO4��5H2O��ʼ������ˮ����113�桫258��ʱʣ���������Ϊ0.57g������ԭ���غ�ɼ������ʱ��Ӧ�Ļ�ѧʽ���軯ѧʽΪCuSO4��nH2O������
����ͼ���֪���¶����ߵ�102����ʱCuSO4��5H2O��ʼ������ˮ����113�桫258��ʱʣ���������Ϊ0.57g������ԭ���غ�ɼ������ʱ��Ӧ�Ļ�ѧʽ���軯ѧʽΪCuSO4��nH2O������
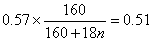 �����n��1������200��ʱ�������ʵĻ�ѧʽΪCuSO4��H2O����2����ͼ���֪���¶ȳ���258��ʱ��ʣ������ǡ����CuSO4�������·ֽ�Ļ�ѧ����ʽ��CuSO4
�����n��1������200��ʱ�������ʵĻ�ѧʽΪCuSO4��H2O����2����ͼ���֪���¶ȳ���258��ʱ��ʣ������ǡ����CuSO4�������·ֽ�Ļ�ѧ����ʽ��CuSO4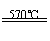
 CuO��SO3����CuO������������CuSO4���ᾧ�������ɵ�����CuSO4��5H2O����ͼ���֪CuSO4��5H2O���ڵ�����¶���102�棻
CuO��SO3����CuO������������CuSO4���ᾧ�������ɵ�����CuSO4��5H2O����ͼ���֪CuSO4��5H2O���ڵ�����¶���102�棻
��3��SO3����ˮ�������ᣬŨ�����ڼ���ʱ��ͭ��Ӧ�Ļ�ѧ����ʽΪ
Cu��2H2SO4 CuSO4��2H2O��SO2��
CuSO4��2H2O��SO2��
��4����ΪKap[Cu��OH��2]��c(Cu2��)��c2(OH��) =2.2��10-20������Һ��pH=8ʱ��c (OH��)��10��6������c(Cu2��)��2.2��10-8������ͭ��Һ��ͨ�����H2S����ʱ��Ӧ�Ļ�ѧ����ʽΪ�� CuSO4��H2S=H2SO4��CuS��������������仯����ԭ���غ��֪���ɵ������Ũ����0.1mol��L-1������H+Ũ����0.2mol��L-1��
���𰸡���1��CuSO4��H2O����2��CuSO4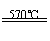
 CuO��SO3����CuSO4��5H2O��102�棻
CuO��SO3����CuSO4��5H2O��102�棻
��3��Cu��2H2SO4 CuSO4��2H2O��SO2��
CuSO4��2H2O��SO2��
��4��2.2��10-8��0.2



 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ƭ��пƬ����ʢ��NaCl��Һ(���е��з�̪)�ı������У���ͼ��ʾ�����ȹ۲쵽��Ϊ��ɫ������Ϊ( )

A����͢� ���� B����͢� C����͢� ���� D����͢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ũҵ������Ա��ũ���飺�����ϴ�������ֲֲ��ʱ�����������ͨ��������C02��
������Ϊ( )
A��C02��ʹ������Ϣ�������Ӷ����β��溦
B��ʩ�ö�����̼�ܴٽ�ֲ����й�����ã���߲���
C. C02�ɲ�������ЧӦ���Ӷ���ߴ����ڵ��¶�
D. CO2�����ʩ�ú��ֹ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ��ʵ�������Ʊ����ռ�������������̼�����������װ��ͼ��ͼ��A��E������
����װ�ô��ţ�����ش��������⡣
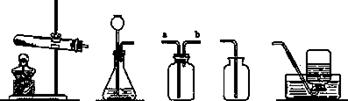
A B C D E
�� ��1����װ��A��E���ӣ���������ȡ_______����װ��B��D���ӣ���������ȡ______��
����2��������һ���ж����壬���ܶȱȿ����Ĵ�������ˮ��ʵ�����ﳣ�ÿ�״����
������������ϡ�����ڳ����·�Ӧ��ȡ�������塣��ѡ��_______��____�����巢��
����װ�ã����ռ�װ����C��������___________����a��b�����뼯��ƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������( K2FeO4)��һ�����͵�����ˮ���������������ʺ�������
A����ǿ�����ԣ�������ɱ������ԭ����������ˮ������
B����ǿ��ԭ�ԣ�������ɱ������������������ˮ������
C����ǿ�����ԣ�������ˮ�����ʣ���ԭ����������ɱ��
D����ǿ��ԭ�ԣ�������ˮ�����ʣ���������������ɱ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
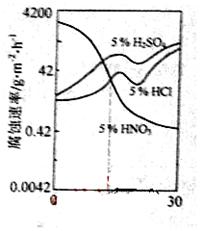
��ͼ��һ��ϡ���Fe-Gr�Ͻ���Cr�����仯�ĸ�ʴ��ʵ�����������й�˵����ȷ����
A.ϡ�����Fe-Cr�Ͻ�ĸ�ʴ�Ա�ϡ�����ϡ�������
B.ϡ���������Ӧ�Ļ�ѧ����ʽ��:Fe+6HNO3(ϡ)��Fe(NO3)3+3NO2��+3H2O
C.Cr��������13%ʱ����Ϊ�������������������Ũ��������Զ�Fe-Cr�Ͻ�ĸ�ʴ����ǿ
D.����Cr�������ӣ�ϡ�����Fe-Cr�Ͻ�ĸ�ʴ�Լ���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��A��B��C��D��E��F��ƿ��ɫ��Һ����������ѧ��ѧ�г��õ����Լ�����EΪ��ɫ��״Һ�壻B��C��D��F������Һ�������ǵ������Ӿ���ͬ���ֽ�������ʵ�飺
��A�д̼�����ζ����մ��Ũ����IJ������ӽ�Aʱ������ɫ������
�ڽ�A�ֱ��������������Һ�У�ֻ��D��F���г��������������������Aʱ��D�г����ޱ仯��F�г�����ȫ�ܽ⣻
�۽�B�ֱ����C��D��E��F�У�C��D��F�в���������E������ɫ����ζ�����ݳ���
�ܽ�C�ֱ����D��E��F�У����г������ɣ��ټ���ϡHNO3�����������ܡ�
��������ʵ����Ϣ����ش��������⣺
��1�� ��ȷ����Һ�ǣ�д����Һ�������Ӧ���ʵĻ�ѧʽ����
��2�� ����ȷ������Һ��д�����š����ʿ��ܵĻ�ѧʽ����һ������ķ�����

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���н�����ʵ�ķ���ʽ����ȷ����(����)
A����0.1 mol/L��ˮ��pHΪ11��
NH3��H2O NH
NH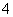 ��OH��
��OH��
B����Na�����ˮ�У��������壺
2Na��2H2O===2NaOH��H2��
C����CuCl2��Һ������ʵ�飬���ݷ��⣺
CuCl2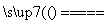 Cu2����2Cl��
Cu2����2Cl��
D��AlƬ����NaOH��Һ�У��������壺
2Al��2OH����2H2O===2AlO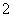 ��3H2��
��3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�ú���A12O3��SiO2������FeO��xFe2O3�������Ʊ�A12(SO4)3��18H2O����������������(���ֲ�����������):
��.�������м������ϡH2SO4������:
��.����Һ�м������KMnO4��Һ��������Һ��pHԼΪ3��
��.���ȣ�����������ɫ���������ã��ϲ���Һ���Ϻ�ɫ:
��.����MnSO4���Ϻ�ɫ��ʧ�����ˣ�
��.Ũ�����ᾧ�����룬�õ���Ʒ��
H2SO4�ܽ�A12O3�����ӷ���ʽ��
KMnO4 - ����Fe2+�����ӷ���ʽ����������

��3����֪�������������������pH
| Al��OH��3 | Fe��OH��2 | Fe��OH��3 | |
| ��ʼ����ʱ | 3.4 | 6.3 | 1.5 |
| ��ȫ����ʱ | 4.7 | 8.3 | 2.8 |
ע���������ӵ���ʼŨ��Ϊ0.1mol��L-1
���ݱ������ݽ��Ͳ�����Ŀ�ģ� ��
(4)��֪:һ�������£�MnO4 - ����Mn2+��Ӧ����MnO2��
�� �� �� �ij����м���ŨHCI�����ȣ���˵�������д���MnO2�������� ��
�� �� �м���MnSO4��Ŀ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com