
将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示,最先观察到变为红色的区域为( )

A.Ⅰ和Ⅱ B.Ⅰ和Ⅳ C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:
下列反应既是氧化还原反应又是离子反应的是( )。
A.钠在氯气中燃烧 B.二氧化碳通入澄清的石灰水中
C.氯化钠溶液中滴加硝酸银溶液 D.锌粒放入稀硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
A.将过量SO2通入少量氨水中:SO2+2NH3·H2O==2NH4++SO32-
B.实验室用Cu和稀HNO3反应制取少量NO气体:
Cu+4H++NO3- ==Cu2++NO↑+2H2O
C.NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O
D.KIO3与KI在酸性溶液中反应:5I-+IO3-+3H2O==3I2+6OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钢铁腐蚀的叙述正确的是( )
A.吸氧腐蚀时正极放出氧气 B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率 D.析氢腐蚀比吸氧腐蚀普遍
查看答案和解析>>
科目:高中化学 来源: 题型:
在101 kPa时燃烧1 t含FeS2质量分数为70%的黄铁矿生成固态Fe2O3和气态SO2,放出4.98×106 kJ的热量,表示上述反应的热化学方程式正确的是( )
A.4FeS2(s)+11O2(g)===2Fe2O3(s)+8SO2(g);ΔH=+853.7 kJ·mol-1
B.FeS2(s)+11/4O2(g)===1/2Fe2O3(s)+2SO2(g);ΔH=-853.7 kJ·mol-1
C.4FeS2(s)+11O2(g)===2Fe2O3(s)+8SO2(g);ΔH=+3 414.8 kJ·mol-1
D.FeS2(s)+11/4O2(g)===1/2Fe2O3(s)+2SO2(g);ΔH=-3 414.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
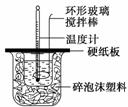 (1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。
(1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则写出该反应的热化学方程式 (ΔH值保留到小数点后1位)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的ΔH____________(填“偏大”、“偏小”或“不变”),其原因是________________________________。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热ΔH会____________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组无机酸的酸性强弱比较正确的是
A.HClO>HClO2>HClO3>HClO4 B.HF<HCl<HBr<HI
C.H2CO3<H2SiO3<H2GeO3 D.HNO3<H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为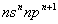 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,第一电离能从大到小的顺序是 (填元素符号);
(2)E的离子结构示意图为_____________, A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出其电离方程式__________________________;
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的结构式 ;
(4)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。写出Y与盐酸反应生成两种新物质的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
0.80gCuSO4·5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
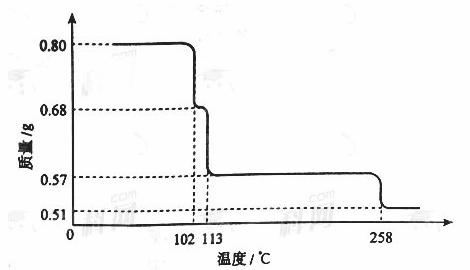
请回答下列问题:
(1)试确定200℃时固体物质的化学式______________(要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为______________。把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为_________,其存在的最高温度是_____________;
(3)上述氧化性气体与水反应生成一种化合物,该化合物的浓溶液与Cu在加热时发生反应的化学方程式为________________;
(4)在0.10mol·L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=________________m ol·L-1(Kap[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。
ol·L-1(Kap[Cu(OH)2]=2.2×10-20)。若在0.1mol·L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是_______________mol·L-1。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com