
下列关于钢铁腐蚀的叙述正确的是( )
A.吸氧腐蚀时正极放出氧气 B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率 D.析氢腐蚀比吸氧腐蚀普遍
科目:高中化学 来源: 题型:
A、B两种固体,都由甲、乙两种元素组成。在A、B中,甲、乙两种元素的原子个数比分别为1∶1和
1∶2。高温煅烧A、B时,产物都是C(固体)和D(气体)。由D可制得E(酸)。E和另一种酸组成的混合酸跟甲苯反应可生成三硝基甲苯。C与E的稀溶液反应得到溶液F,往F溶液中加入NaOH溶液,有红褐色沉淀生成,该沉淀经灼烧后转变成C。往F溶液中加入甲元素的单质得到溶液G。试根据以上信息填写下列空白:
(1)A的化学式(分子式)是
(2)B煅烧生成C和D的化学方程式是
甲元素的单质与F溶液反应的离子方程式是
(3)往G溶液中加入NaOH溶液发生的现象是
查看答案和解析>>
科目:高中化学 来源: 题型:
有一瓶澄清的溶液,其中可能含有NH4+、K+、Na+、Mg2+、Al3+、
Fe3+、SO42―、CO32―、Cl―和I―。你取该溶液进行了以下实验:
(1)用pH试纸检验,表明溶液呈强酸性;
(2)取部分溶液,加入CCl4及数滴氯水,经振荡后CCl4层呈紫红色;
(3)另取部分溶液,加入稀NaOH 溶液使其变为碱性,溶液中最终无沉淀;
(4)取部分上述碱性溶液,通入过量CO2气体有白色沉淀生成;
(5)将(3)得到的碱性溶液加热,有气体放出,该气体能使润湿的红色石蕊试纸变蓝;根据上述实验事实,你可知道该溶液中:
① 肯定含有的离子是 ;
② 肯定不存在的离子是 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有NH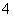 、Mg2+、Fe2+、Al3+和SO
、Mg2+、Fe2+、Al3+和SO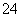 五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
五种离子,若向其中加入过量的Ba(OH)2溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
A.4种 B.3种 C.2种 D.1种
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.无水氯化铝是有机化工常用催化剂,其外观为白色固体,178℃时升华,极易潮解,遇水后会发热并产生白雾。实验室用如下装置制备少量无水氯化铝,其反应原理为:2Al + 6HCl(g) = 2AlCl3 + 3H2
完成下列填空:
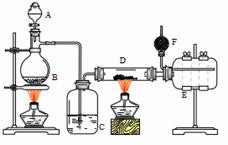
A为浓硫酸,B为NaCl固体
(1)进行实验时应先点燃 (选填“B”或“D”)处酒精灯。
(2)用粗短导管连接D、E的目的是________(选填序号)。
a. 防堵塞 b. 防倒吸 c. 平衡气压 d. 冷凝回流
(3)F中盛有碱石灰,其目的是 (选填序号)。
a. 吸收多余HCl b. 吸收Cl2 c. 吸收CO2 d. 防止空气中H2O进入E瓶
(4)将D中固体改为氯化铝晶体(AlCl3·6H2O)也能进行无水氯化铝的制备,此时通入HCl气体的目的是 。若实验条件控制不当,最终得到的物质是碱式氯化铝[化学式为Al2(OH)nCl(6-n)],且质量是原氯化铝晶体(AlCl3·6H2O)的40%,则可推算n的值为 。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。Na2S2O5溶于水即生成NaHSO3。
(1)证明NaHSO3溶液中HSO3—的电离程度大于水解程度,可采用的实验方法是 (填序号)。
| a.测定溶液的pH | b.加入Ba(OH)2溶液 | c.加入盐酸 |
| d.加入品红溶液 | e.用蓝色石蕊试纸检测 |
(2)检验Na2S2O5晶体在空气中已被氧化的实验方案是________ ______。
(3)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量的方案如下:

(已知:滴定时反应的化学方程式为SO2 + I2 + 2 H2O = H2SO4 + 2 HI)
按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为 g/L。在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍有广泛的用途,粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+) ( )
A.阳极发生还原反应,其电极反应式为:Ni2++2e→Ni
B.电解过程中,阳极质量的减少量与阴极质量的增加量相等
C.电解后,电解槽底部的阳极泥中只有Cu和Pt
D.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
查看答案和解析>>
科目:高中化学 来源: 题型:
将铁片和锌片放在盛有NaCl溶液(其中滴有酚酞)的表面皿中,如图所示,最先观察到变为红色的区域为( )

A.Ⅰ和Ⅱ B.Ⅰ和Ⅳ C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
查看答案和解析>>
科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①

查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室里制备和收集氧气、二氧化碳等气体的仪器装置图(图中A~E是仪器
装置代号),请回答下列问题。
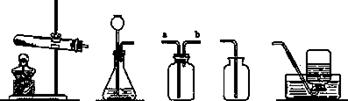
A B C D E
(1)将装置A和E连接,可用于制取_______,将装置B和D连接,可用于制取______;
(2)硫化氢是一种有毒气体,其密度比空气的大,能溶于水。实验室里常用块状固体
硫化亚铁和稀硫酸在常温下反应制取硫化氢气体。可选用_______ ____作气体发生
装置,若收集装置是C,气体由___________(填a或b)导入集气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com