
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①

科目:高中化学 来源: 题型:
设NA表示阿伏伽德罗常数,下列说法中不正确的是( )
A、一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数小于NA
B、1molFeCl3完全水解转化为氢氧化铁胶体后能生成NA个胶粒
C、0.01molMg在空气中完全燃烧生成MgO和Mg3N2,转移电子数目为0.02NA
D、125gCuSO4•5H2O晶体中含有0.5NA个Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于钢铁腐蚀的叙述正确的是( )
A.吸氧腐蚀时正极放出氧气 B.析氢腐蚀时正极放出氢气
C.化学腐蚀速率超过电化学腐蚀速率 D.析氢腐蚀比吸氧腐蚀普遍
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组设计用50 mL 1.0 mol/L盐酸跟50 mL 1.1 mol/L 氢氧化钠溶液在如图装置中进行中和反应。在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平。然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过。通过测定反应过程中所放出的热量可计算中和热。试回答下列问题:
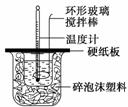 (1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。
(1)本实验中用稍过量的NaOH的原因是 。在大小烧杯中填充泡沫塑料的作用是 。
(2)该实验小组做了三次实验,每次取溶液各50 mL,并记录下原始数据(见下表)。
| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
已知盐酸、NaOH溶液密度近似为1.00 g/cm3,中和后混合液的比热容c=4.18×10-3kJ/(g·℃),则写出该反应的热化学方程式 (ΔH值保留到小数点后1位)。
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会比(2)测出的ΔH____________(填“偏大”、“偏小”或“不变”),其原因是________________________________。
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸后再用温度计测定NaOH溶液温度的步骤,若无此操作步骤,则测得的中和热ΔH会____________(填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组无机酸的酸性强弱比较正确的是
A.HClO>HClO2>HClO3>HClO4 B.HF<HCl<HBr<HI
C.H2CO3<H2SiO3<H2GeO3 D.HNO3<H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;
X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体是一种重要的半导体材料。下列说法正确的是
A.X、M两种元素形成的化合物的中一定含有离子键,不可能含有共价键
B.由于W、Z、M元素的氢化物的相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W、M的电负性高低顺序为:M>W>Z>Y
D.化合物ZW2的分子空间构型为直线形
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期中五种元素A、B、C、D、E原子序数依次增大,其中A、B、C原子核外电子层数之和是5,且C原子最外层上的电子数为A和B两元素原子最外电子层上电子数的总和,C原子的价电子构型为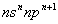 ,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
,A原子的最外层电子数等于其电子层数。D和E可以形成原子个数比为1:1和1:2的两种离子化合物,且D原子的2p能级上有两个未成对电子,试回答下列问题:
(1)B、C、D、E四种元素的原子,第一电离能从大到小的顺序是 (填元素符号);
(2)E的离子结构示意图为_____________, A、D可形成多种化合物,其中一种是氧化剂,其水溶液有弱酸性,写出其电离方程式__________________________;
(3) A、B、D三种元素可以形成多种有机化合物分子,其中最简单原子数最少的一种是室内装潢时形成的主要气体污染物。试写出它的结构式 ;
(4)C和E形成一种离子化合物Y,其摩尔质量为65 g/mol,Y受热或撞击时立即分解为两种单质。写出Y与盐酸反应生成两种新物质的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A. 将燃着的木条伸入充满气体的集气瓶中,木条熄灭,则该瓶中的气体一定是CO2
B. 将紫色石蕊试液滴入某无色溶液中呈现红色,该溶液中一定有CO2
C. 将盛有澄清石灰水的试剂瓶敞口放置,石灰水表面会有一层白膜生成
D. 人与动物的呼吸作用是吸进氧气,呼出CO2;而植物的呼吸作用相反,吸进CO2,
呼出O2,所以树林中空气新鲜
查看答案和解析>>
科目:高中化学 来源: 题型:
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验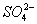 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验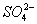 的操作是_____________。
的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com