
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ.FeSO4溶液与稍过量的NH4HCO3溶液混合,得到含FeCO3的浊液。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到Fe2O3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的Fe3+,该反应的离子方程式是_________________。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用_____________。
(3)Ⅲ中,生成FeCO3的离子方程式是_____________。若FeCO3浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是_____________。
(4)Ⅳ中,通过检验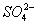 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验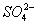 的操作是_____________。
的操作是_____________。
(5)已知煅烧FeCO3的化学方程式是4FeCO3+O2 2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)
2Fe2O3+4CO2。现煅烧464.0 kg的FeCO3,得到316.8 kg产品。若产品中杂质只有FeO,则该产品中Fe2O3的质量是_________ kg。(摩尔质量/g·mol-1:FeCO3 116 Fe2O3 160 FeO 72)

【答案】
(1)Fe+2Fe3+====2Fe2+
(2)加入硫酸,H+浓度增大,使Fe2++2H2O  Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制FeSO4的水解
(3)Fe2++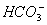 ====FeCO3↓+H+
====FeCO3↓+H+
4FeCO3+6H2O+O2====4Fe(OH)3↓+4CO2
(4)取少量洗涤后的滤液放入试管中,滴加酸化的BaCl2溶液,若无白色沉淀产生,则沉淀洗涤干净
(5)288.0
(2)FeSO4+2H2O F
F e(OH)2+H2SO4,加入H2SO4,平衡逆移,抑制水解。
e(OH)2+H2SO4,加入H2SO4,平衡逆移,抑制水解。
(3)“红褐色”提示生成Fe(OH)3。
(4)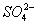 检验:说明步骤,指明试剂、现象、结论。
检验:说明步骤,指明试剂、现象、结论。
(5)设产品中FeO、Fe2O3物质的量分别为a mol、b mol。
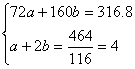 求得:b=1.8 mol
求得:b=1.8 mol
m(Fe2O3)=1.8 mol×160 g·mol-1=288.0 g。



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①

查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室里制备和收集氧气、二氧化碳等气体的仪器装置图(图中A~E是仪器
装置代号),请回答下列问题。
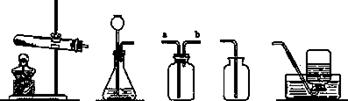
A B C D E
(1)将装置A和E连接,可用于制取_______,将装置B和D连接,可用于制取______;
(2)硫化氢是一种有毒气体,其密度比空气的大,能溶于水。实验室里常用块状固体
硫化亚铁和稀硫酸在常温下反应制取硫化氢气体。可选用_______ ____作气体发生
装置,若收集装置是C,气体由___________(填a或b)导入集气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
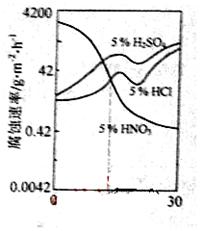
右图是一种稀硫对Fe-Gr合金随Cr含量变化的腐蚀性实验结果,下列有关说法正确的是
A.稀硫酸对Fe-Cr合金的腐蚀性比稀硫酸和稀盐酸的弱
B.稀硝酸和铁反应的化学方程式是:Fe+6HNO3(稀)—Fe(NO3)3+3NO2↑+3H2O
C.Cr含量大于13%时,因为三种酸中硫酸的氢离子浓度最大,所以对Fe-Cr合金的腐蚀性最强
D.随着Cr含量增加,稀硫酸对Fe-Cr合金的腐蚀性减弱

查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E和F六瓶无色溶液,他们是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五中溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
(1) 能确定溶液是(写出溶液标号与相应溶质的化学式):
(2) 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:

查看答案和解析>>
科目:高中化学 来源: 题型:
下图中X是一种具有水果香味的合成香料,A是直链有机物,E与FeCl3溶液作用显紫色。
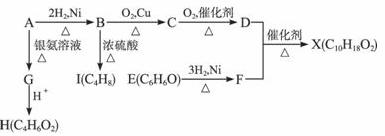
请根据上述信息回答:
(1)H中含氧官能团的名称是____________,B→I的反应类型为____________。
(2)只用一种试剂鉴别D、E、H,该试剂是____________。
(3)H与J互为同分异构体,J在酸性条件下水解有乙酸生成,J的结构简式为____________。
(4)D和F反应生成X的化学方程式为____________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
下列解释事实的方程式不正确的是( )
A.测0.1 mol/L氨水的pH为11:
NH3·H2O NH
NH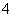 +OH-
+OH-
B.将Na块放入水中,产生气体:
2Na+2H2O===2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:
CuCl2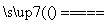 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:
2Al+2OH-+2H2O===2AlO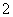 +3H2↑
+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是( )
A.氢气通过灼热的CuO粉末
B.二氧化碳通过Na2O2粉末
C.铝与Fe2O3发生铝热反应
D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
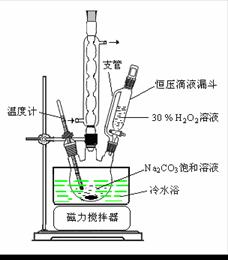
过碳酸钠(2Na2CO3·3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂。某兴趣小组制备过碳酸钠的实验方案和装置示意图如下:
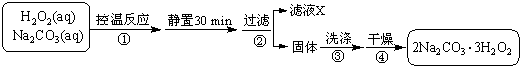 已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)
已知:主反应 2Na2CO3 (aq) + 3H2O2 (aq)  2Na2CO3·3H2O2 (s) ΔH < 0
2Na2CO3·3H2O2 (s) ΔH < 0
副反应 2H2O2 = 2H2O + O2↑
滴定反应 6KMnO4 + 5(2Na2CO3·3H2O2) +19H2SO4 =
3K2SO4 + 6MnSO4 +10Na2SO4 + 10CO2 ↑ + 15O2↑ + 34H2O
 50 °C时 2Na2CO3·3H2O2 (s) 开始分解
50 °C时 2Na2CO3·3H2O2 (s) 开始分解
请回答下列问题:
(1)图中支管的作用是 。
(2)步骤①的关键是控制温度,其措施有 、
和 。
(3)在滤液X中加入适量NaCl固体或无水乙醇,
均可析出过碳酸钠,原因是 。
(4)步骤③中选用无水乙醇洗涤产品的目的
是 。
(5)下列物质中,会引起过碳酸钠分解的有 。
A.Fe2O3 B.CuO
C.Na2SiO3 D.MgSO4
(6)准确称取0.2000 g 过碳酸钠于250 mL 锥形瓶中,加50 mL 蒸馏水溶解,再加50 mL 2.0 mol·L-1 H2SO4,用2.000×10-2 mol·L-1 KMnO4 标准溶液滴定至终点时消耗30.00 mL,则产品中H2O2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com