
分析 (1)根据实验现象,确定维生素C的性质,缺少维生素C会患坏血病;
(2)设人体的质量为m,则人体中该元素原子的物质的量=m×$\frac{质量分数}{该元素的摩尔质量}$.
解答 解:(1)向一片新鲜水果的切面上滴加淀粉溶液和碘水,出现蓝色后又慢慢褪去,说明维生素C把单质碘还原为碘离子,故维生素C具有还原性,缺少维生素C医患坏血病,故答案为:坏血;褪色;还原;
(2)设人体的质量为m,则人体中该元素原子的物质的量=m×$\frac{质量分数}{该元素的摩尔质量}$,所以
n(C)=m×$\frac{18%}{12}$=0.012mmol,n(H)=m×$\frac{10%}{1}$=0.1mmol,n(O)=m×$\frac{65%}{16}$=0.041mmol
故答案为:H.
点评 本题考查了化学与生活,涉及维生素、物质的量的有关计算,题目难度不大,但易错,注意把握物质的量与质量有关计算公式的运用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | E、C、D、B、A | B. | B、A、E、D、C | C. | E、B、A、D、C | D. | A、B、C、D、E |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3)(4)(5) | B. | (4)(5)(7)) | C. | (4)(5) | D. | (3)(4)(5)(7) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
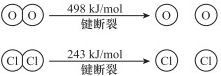
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 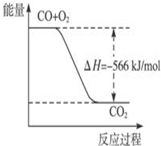 图可表示由CO生成CO2的反应过程和能量关系 | |
| B. | CO的燃烧热为566 kJ/mol | |
| C. | Na2O2(s)+CO2(s)=Na2CO3(s)+$\frac{1}{2}$O2(g)△H=-226 kJ/mol | |
| D. | CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com