
分析 (1)次氯酸钠在强碱性的NaOH溶液中氧化Fe(NO3)3生成Na2FeO4,结合质量守恒配平;
(2)①反应ⅲ只要开始进行就会生成Fe3+,所以不能用KSCN作为指示剂.
②反应中Cr的化合价从+3价升高到了+6价,失去了3mol电子;Fe元素的化合价从+6价降低到了+3价,得到了3mol电子,根据电子守恒、元素守恒来配平方程式;
③根据发生的反应得到如下关系:Na2FeO4~CrO42-~0.5Cr2O72-~3Fe2+,结合关系式计算.
解答 解:(1)次氯酸钠在强碱性的NaOH溶液中氧化Fe(NO3)3生成Na2FeO4,反应的方程式为3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O,
故答案为:3NaClO+2Fe(NO3)3+10NaOH=2Na2FeO4+3NaCl+6NaNO3+5H2O;
(2)①反应ⅲ只要开始进行就会生成Fe3+,所以不能用KSCN作为指示剂,故答案为:否;只要反应开始进行就会生成Fe3+,不能指示滴定终点;
②反应中Cr的化合价从+3价升高到了+6价,失去了3mol电子;Fe元素的化合价从+6价降低到了+3价,得到了3mol电子,反应的离子方程式为Cr(OH)4-+FeO42-+3H2O=Fe(OH)3(H2O)3↓+CrO42-+OH-,
故答案为:1;1;3H2O;1;1; 1OH-;
③根据发生的反应得到如下关系:Na2FeO4~CrO42-~0.5Cr2O72-~3Fe2+,
所以样品的纯度为$\frac{28.00L×1{0}^{-3}×1.00mol/L×166g/mol}{3×2.00g}×100%$=77.5%.
故答案为:77.5%.
点评 本题考查物质的含量的测定,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握物质的性质,结合反应的转化关系计算,题目难度中等.


科目:高中化学 来源: 题型:解答题
 ;
;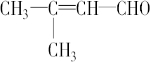 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验设计 |
| A | 制备Fe(OH)3胶体 | 向0.1mol•L-1的FeCl3溶液中加入等体积0.3mol•L-1的NaOH溶液,煮沸 |
| B | 除去CO2中的HCl | 将混合气体依次通入Na2CO3溶液和浓硫酸中 |
| C | 检验溶液中是否含有SO42- | 取少量待检测溶液,向其中加入Ba(NO3)2溶液,再加入少量盐酸,观察实验现象 |
| D | 验证氧化性:Fe3+<Br2<Cl2 | 向试管中依次加入1mL0.1mol•L-1FeBr2溶液,几滴KSCN溶液和1mL苯,然后逐滴加入氯水,轻轻振荡,观察整个过程中有机相和水相中的现象 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
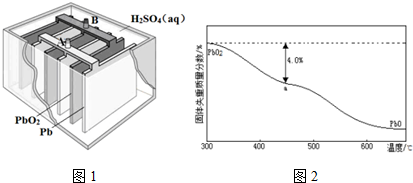
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
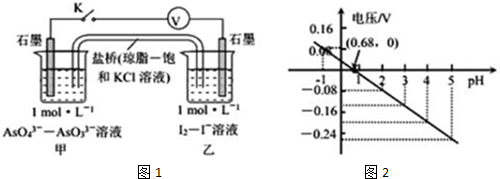
| A. | pH>0.68时,甲烧杯中石墨为负极 | |
| B. | pH=0.68时,反应处于平衡状态 | |
| C. | pH<0.68时,氧化性I2<AsO43- | |
| D. | pH=5时,负极电极反应式为2I--2e-=I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子间作用力,离子键 | B. | 化学键,分子间作用力 | ||
| C. | 化学键,化学键 | D. | 分子间作用力,分子间作用力 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
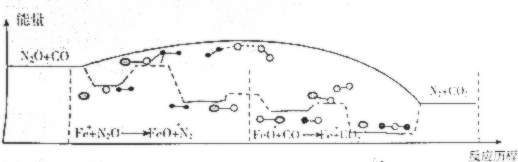
| A. | N2O与CO反应的△H<0 | |
| B. | FeO+也是该反应的催化剂 | |
| C. | Fe+使该反应的活化能减小 | |
| D. | Fe++N2O→FeO++N2、FeO++CO→Fe++CO2两步反应均为放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com