
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不用硫酸的原因是___________________。
(2)操作Ⅱ的目的是__________________,溶液A(溶质是共价化合物)是___________________。
(3)写出检验滤液中是否含铁离子的方法:___________________。
(4)写出加入碳酸铵所发生反应的离子方程式:___________________,写出滤液B的一种用途:___________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
实验步骤:
①___________________;②加入___________________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为___________________。
 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:
氢气(H2)、一氧化碳(CO)、辛烷(C8H18)、甲烷(CH4)的热化学方程式分别为:
H2 (g) + 1/2O2(g) == H2O (l); △H = -285.8 KJ/mol
CO(g) + 1/2O2(g) == CO2(g); △H = -283.0 KJ/mol
C8H18 (l) +(25/2)O2(g) == 8CO2(g) + 9H2O (l); △H = -5518 KJ/mol
CH4 (g) + 2O2(g) == CO2(g) + 2H2O  (l); △H = -890.3 KJ/mol
(l); △H = -890.3 KJ/mol
相同质量的H2、CO、C8H18、CH4完全燃烧时,放出热量最少的是
A.H2 (g) B.CO(g)
C.C8H18 (l) D.CH4 (g)
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明在实验室制备Cl2的过程中会有水蒸气和HCl挥发出来,甲同学设计了如下图所示的实验装置,按要求回答问题。
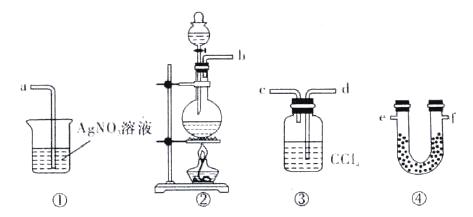
(1)请根据甲同学的意图,连接相应的装置,接口的顺序:b接______,_______接______,______接a。
(2)U形管中所盛试剂的化学式为_________________。
(3)装置③中CCl4的作用是________________。
(4)乙同学认为甲同学实验有缺陷,不能证明最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加装置⑤。你认为装置⑤应加在_______之间(填装置序号)。瓶中可以放入______________________________________________________。

(5)丙同学看到甲同学设计的装置后提出无需多加装置,只需将原来烧杯中AgNO3溶液换成其它溶液。你认为可将溶液换成_____________,如果观察到_____________________的现象,则证明制Cl2时有HCl挥发出来。
查看答案和解析>>
科目:高中化学 来源: 题型:
锂离子电池的广泛应用使回收利用锂货 源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
源成为重要课题:某研究性学习小组对废旧锂离子电池正极材料(LiMn2O4、碳粉等涂覆在铝箔上)进行资源回收研究,设计实验流程如下:
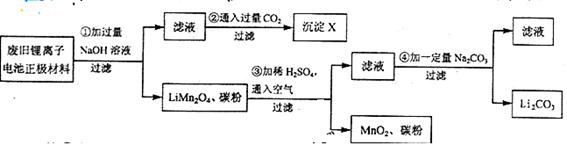
(1)第②步反应得到的沉淀X的化学式为 。
(2)第③步反应的离子方程式是 。
(3)第④步反应后,过滤Li2CO3所需的玻璃仪器有 。
若过滤时发现滤液中有少量浑浊,从实验操作的角度给出两种可能的原因:
、 。
(4)若废旧锂离子电池正极材料含LiNB2O4的质量为18.1 g第③步反应中加入20.0mL3.0mol·L-1的H2SO4溶液。定正极材料中的锂经反应③和④完全为Li2CO3,剩至少有 Na2CO3参加了反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用 方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是 否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
| 实验方法 | 实验现象及结论 |
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:

步骤②的操作名称是  ,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是 。
,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组利用如下装置(部分固定装置略)制备氮化钙(Ca3N2),并探究其实验式。

(1)按图连接好实验装置。检查装置的气密性,方法是_____________________
______________________________________________________________________。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是_______________________
_______________________________________。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后,__________________;④拆除装置,取出产物。
(4)数据记录如下:
| 空瓷舟质量m0/g | 瓷舟与钙的质量m1/g | 瓷舟与产物的质量m2/g |
| 14.80 | 15.08 | 15.15 |
①计算得到实验式CaxN2,其中x=_______________________。
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据:_________________
___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如下:
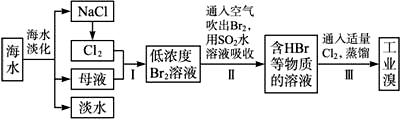
(1)请列举海水淡化的两种方法:__________________、__________________。
(2)将NaCl溶液进行电解,在电解槽中可直接得到的产品有H2、_________、_________或H2、_________。
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为__________________。
(4)步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式为_________,由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_______________________。
(5)某化学研究性学习小组为了解从工业溴中提纯溴的方法,查阅了有关资料:Br2的沸点为59 ℃,微溶于水,有毒性和强腐蚀性。他们参观生产过程后,绘制了如下装置简图:

请你参与分析讨论:
①图中仪器B的名称:______________________。
②整套实验装置中仪器连接均不能用橡胶塞和橡胶管,其原因为_______________。
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:_______________。
④C中液体产物颜色为_______________,为除去该产物中仍残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是
A.Ba(OH)2 KSCN NaCl Mg(NO3)2 (FeCl3溶液)
B.NaNO3 NaHCO3 (NH4)2SO3 Na2SiO3 (H2SO4溶液)
C.NH4Br K2CO3 NaI CaCl2 (AgNO3溶液)
D.(NH4)3PO4 NaBr CuSO4 AlCl3 (KOH溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com