
为测试一铁片中铁元素的含量,某课外活动小组提出下面两种方案并进行了实验(以下数据为多次平行实验测定结果的平均值):
方案一:将a g铁片完全溶解于过量稀硫酸中,测得生成氢气的体积为580mL(标准状况);
方案二:将 g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
g铁片完全溶解于过量稀硫酸中,将反应后得到的溶液用0.02000mol·L-1
的KMnO4溶液滴定,达到终点时消耗了25.00mL KMnO4溶液。
请回答下列问题:
(1)配平下面的化学方程式:
□KMnO4+□FeSO4+□H2SO4=□Fe2(SO4)3+□MnSO4+□K2SO4+□H2O
(2)在滴定实验中不能选择 式滴定管,理由是 ;
(3)根据方案一和方案二测定的结果计算,铁片中铁的质量分数依次为 和
;(铁的相对原子质量以55.9计)
(4)若排除实验仪器和操作的影响因素,试对上述两种方案测定结果的准确性做出判断和分析。
①方案一 (填“准确”“不准确”“不一定准确”),理由是 ;
②方案二 (填“准确”“不准确”“不一定准确”),理由是 。
【答案】
(1)2 10 8 5 2 1 8
(2)碱 KMnO4是强氧化剂,它会腐蚀乳胶管
(3)
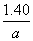
(4)①不一定准确 如果铁片中存在与稀硫酸反应并能生成氢气的其他金属,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低;如果上述情况均不存在,则结果准确
②不一定准确 如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果铁片中存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低;如果上述情况均不存在,则结果准确
注:本小题属于开放性试题,若回答“准确”或“不准确”且理由合理,可酌情给分。例如:考生回答
方案一准确,因为铁片中不存在能与稀硫酸反应并能生成氢气的其他金属,也不存在铁的氧化物
方案一不准确,如果铁片中存在与稀硫酸反应生成氢气的其他金属,会导致结果偏高;如果存在与稀硫酸反应而溶解、但不产生氢气的铁的氧化物,会导致结果偏低
方案二准确,铁片溶于稀硫酸后,除Fe2+外,其他可能存在的金属离子在酸性溶液中均不能被高锰酸钾氧化,也不存在氧化铁
方案二不准确,如果铁片中存在与稀硫酸反应而溶解的其他金属,生成的金属离子在酸性溶液中能被高锰酸钾氧化,会导致结果偏高;如果存在与稀硫酸反应而溶解的铁的氧化物,生成的Fe3+离子在酸性溶液中不能被高锰酸钾氧化,会导致结果偏低
【解析】本题结合铁元素含量测定实验对氧化还原、滴定实验、化学计算及实验结果的评价等综合进行考查。
(1)根据化合价升降法配平如下化学方程式:
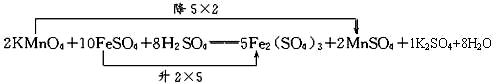
故其化学计量数分别为:2、10、8、5、2、1、8。
(2)方案二中滴定实验时,KMnO4溶液盛装在滴定管中,应选择酸式滴定管而不能用碱式滴定管,原因是KMnO4溶液是强氧化剂,具有强氧化性,它能腐蚀碱式滴定管的橡皮管。
(3)根据题干条件,铁片中铁的质量分数分别为:
方案一中: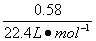 ×55.9 g·mol-1/a g=
×55.9 g·mol-1/a g=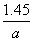
方案二中:0.02 mol·L-1×0.025 L×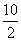 ×55.9 g·mol-1/
×55.9 g·mol-1/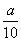 g=1.40/a
g=1.40/a
(4)本小题是对实验中测定结果进行误差分析和方案评价的问题,是属于开放性的问题,回答“准确”“不准确”或“不一定准确”均可,但要相应说明结论的理由,详见参考答案。


科目:高中化学 来源: 题型:
下列有关实验操作的叙述正确的是
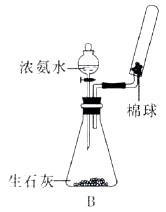
A.实验室利用右图所示装置制取并收集氨气
B.用洁净的玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液pH
C.用铂丝蘸取某溶液于无色火焰灼烧,透过蓝色钴玻璃观察,火焰呈浅紫色,证明其中含K+
D.在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤分离出苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:

(1)溶解大理石时,用硝酸而不用硫酸的原因是___________________。
(2)操作Ⅱ的目的是__________________,溶液A(溶质是共价化合物)是___________________。
(3)写出检验滤液中是否含铁离子的方法:___________________。
(4)写出加入碳酸铵所发生反应的离子方程式:___________________,写出滤液B的一种用途:___________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞 仪器:电子天平、锥形瓶、滴定管
实验步骤:
①___________________;②加入___________________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到目的的是( )
A.在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸
B.用稀硫酸和锌粒反应制氢气时加入少许硫酸铜以加快反应速率
C.用玻璃棒搅拌漏斗中的液体以加快过滤速度
D.加入盐酸以除去硫酸钠中的少量碳酸钠杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
下图的装置中,干燥烧瓶内盛有某种气体,烧杯和滴管内盛放某种溶液。挤压滴管的胶头,下列与实验事实不相符的是 ( )

A.CO2(NaHCO3溶液)/无色喷泉 B.NH3(H2O含酚酞)/红色喷泉
C.H2S(CuSO4溶液)/黑色喷泉 D.HCl(AgNO3溶液)/白色喷泉
查看答案和解析>>
科目:高中化学 来源: 题型:
取化学式为MZ的黄色粉末状化合物进行如下实验。将MZ和足量碳粉充分混合,平铺在反应管a中,在b瓶中盛足量澄清石灰水。按图连接仪器。
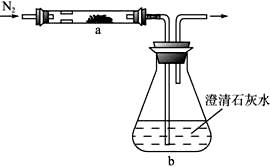
实验开始时缓缓通入氮气,过一段时间后,加热反应管a,观察到管内发生剧烈反应,并有熔融物生成。同时,b瓶的溶液中出现白色浑浊。待反应完全后,停止加热,仍继续通氮气,直至反应管冷却。此时,管中的熔融物凝固成银白色金属。根据以上叙述回答问题:
(1)元素Z是 :
(2)停止加热前是否需要先断开a和b的连接处?为什么?
;
(3)反应管a中发生的所有反应的化学方程式是
;
(4)本实验的尾气是否需处理?如需处理,请回答如何处理:如不需处理,请说明理由。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某混合金属粉末,除铝外还含有铁、铜中的一种或两种,所含金属的量都在5%以上。请设计合理实验探究该混合物金属粉末中铁、铜元素的存在。
仅限选择的仪器和试剂:烧杯、试管、玻璃棒、量筒、容量瓶、滴管、药匙;1mol/L硫酸、2mol/L硝酸、2mol/LNaOH溶液、20%KSCN溶液。
完成以下实验探究过程:
(1)提出假设:
假设1:该混合金属粉末中除铝外还含有 元素;
假设2:该混合金属粉末中除铝外还含有 元素;
假设3:该混合金属粉末中除铝外还含有Fe、Cu元素;
(2)设计实验方案
基于假设3,设计出实验方案。
(3)实验过程
根据(2)的实验方案,叙述实验操作、预期现象和结论。
| 编号 | 实验操作 | 预期现象和结论 |
| ① | ||
| ② | ||
| ③ | ||
| ④ | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
水蒸气通过灼热的焦炭后,流出气体的主要成分是CO和H2,还有CO2和水蒸气等。请用下图中提供的仪器,选择必要的试剂,设计一个实验,证明上述混合气中有CO和H2。(加热装置和导管等在图中略去)
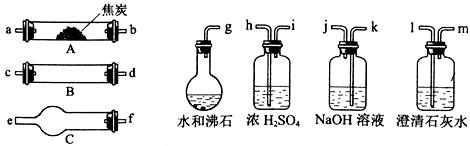
回答下列问题:
(1)盛浓H2SO4的装置用途是 ,盛NaOH溶液的装置用途是 。
(2)仪器B中需加入试剂的名称(或化学式)是: ,所发生反应的化学方程式是: 。
(3)仪器C中需加入试剂的名称(或化学式)是: ,其目的是 。
(4)按气流方向连接各仪器,用字母表示接口的连接顺序:g—ab—  。
。
(5)能证明混合气中含有CO的实验依据是 。
(6)能证明混合气中含有H2的实验依据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
I2在KI溶液中存在平衡:  ,某I2、、KI混合溶液中, c(
,某I2、、KI混合溶液中, c( )与温度T的平衡曲线图如下。下列说法不正确的是
)与温度T的平衡曲线图如下。下列说法不正确的是

A. 反应 的△H>0
的△H>0
B.若温度为 ,反应的平衡常数分别为
,反应的平衡常数分别为
C.若反应进行到状态D时,一定有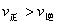
D.状态A与状态B相比,状态A的c(I2) 小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com