
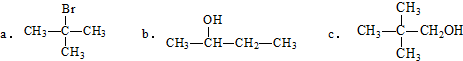
 .
.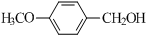 与O2反应制得,写出该反应的化学方程式
与O2反应制得,写出该反应的化学方程式 .
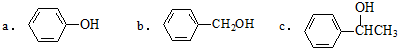
. 分析 (1)①卤代烃、醇发生消去反应,卤素原子、羟基邻位碳原子含有氢原子;
②能被氧化成醛类物质的应为伯醇,含有-CH2OH结构;
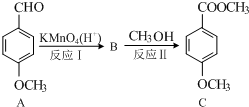
(2)A被氧化,-CHO转化为-COOH生成B,则B的结构简式为 ,
, 与甲醇发生酯化反应生成C,
与甲醇发生酯化反应生成C, 在催化作用下发生氧化还原反应生成A,以此解答该题.
在催化作用下发生氧化还原反应生成A,以此解答该题.
解答 解:(1)①卤代烃、醇发生消去反应,卤素原子、羟基邻位碳原子含有氢原子,只有c不能发生消去反应,故答案为:c;
②能被氧化成醛类物质的应为伯醇,含有-CH2OH结构,只有b符合,故答案为:b;
(2)被氧化,-CHO转化为-COOH生成B,则B的结构简式为 ,
,
①A中苯环和醛基都为平面形结构,与苯环直接相连的原子共平面,则至少有12个原子共平面,故答案为:12;
②C中含氧官能团为酯基和醚基,故答案为:酯基、醚基;
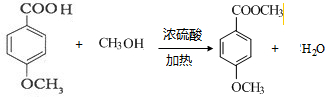
③ 与甲醇发生酯化反应生成C,方程式为
与甲醇发生酯化反应生成C,方程式为 ,
,
故答案为: ;
;
④ 在催化作用下发生氧化还原反应生成A,方程式为
在催化作用下发生氧化还原反应生成A,方程式为 ,
,
故答案为: .
.
点评 本题考查以有机物合成考查有机物结构与性质,为高频考点,涉及醛、酚、羧酸性质的考查,把握官能团与性质的关系即可解答,题目难度不大.


 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源: 题型:选择题
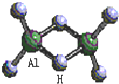 科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )
科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上.最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关推测肯定不正确的是( )| A. | Al2H6跟水的反应可能是氧化还原反应,产物之一可能是氢氧化铝 | |
| B. | Al2H6在空气中完全燃烧,产物为氧化铝和水 | |
| C. | Al2H6分子是极性分子 | |
| D. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>R>T | |
| B. | XR2、WR2两化合物中R的化合价相同 | |
| C. | 最高价氧化物对应的水化物碱性:X>Z | |
| D. | 气态氢化物的稳定性:W<R<T |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
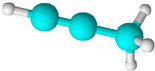
| A. | 结构简式为CH3CCH | B. | 所有原子位于同一平面内 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 一定条件下,能发生缩聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2作氧化剂,发生还原反应 | |
| B. | 钾元素化合价降低 | |
| C. | 该反应是置换反应 | |
| D. | 每生成2 mol K2FeO4,转移3 mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
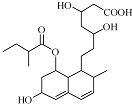 普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )
普伐他汀是一种调节血脂的药物,其结构简式如图所示.下列关于普伐他汀的性质描述正确的是( )| A. | 能与FeCl3 溶液发生显色反应 | |
| B. | 能使溴的CCl4溶液褪色 | |
| C. | 能发生加成、取代、消去反应 | |
| D. | 1 mol 该物质最多可与1 mol NaOH 反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
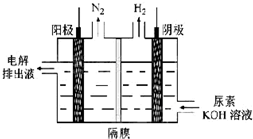 碳及其化合物的研究具有重要的现实意义
碳及其化合物的研究具有重要的现实意义| 物质 T/℃n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
 N2+CO2.
N2+CO2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com