
【题目】11、浓度均为 ![]() 的
的![]() 和
和 ![]() ,在一定条件下发生反应
,在一定条件下发生反应![]()
![]()
![]() ,测得
,测得![]() 的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

A.平衡时CO与![]() 的物质的量比为
的物质的量比为![]()
B.![]() 由大到小的顺序为
由大到小的顺序为 ![]()
C.![]() , p
, p![]() 条件下,该反应
条件下,该反应![]() 时达到平衡点X,则
时达到平衡点X,则 ![]()
D.随着温度升高,该反应的平衡常数减小
【答案】D
【解析】
A. 因为生成物CO与H2的物质的量按1:1生成,所以平衡时CO与H2的物质的量比为1:1,故A正确;
B. 由图可知,温度一定时,甲烷的转化率α(P1)>α(P2) >α(P3) >α(P4),该反应正反应是气体体积增大的反应,增大压强平衡向逆反应进行,甲烷的转化率降低,故压强P4>P3>P2>P1,故B正确;
C. 由图可知,压强为P4、1100℃的条件下,达到平衡X点时甲烷的转化率为80%,甲烷的浓度变化量为0.1mol/L×80%=0.08mol/L,则:
CH4(g)+CO2(g)=2CO(g)+2H2(g)
开始(mol/L): 0.1 0.1 0 0
变化(mol/L): 0.08 0.08 0.16 0.16
平衡(mol/L): 0.02 0.02 0.16 0.16
故ν(CO2)=△c÷△t=0.08mol/L÷10min=0.008molL1min1
故C正确;
D. 由图可知,温度越高,CH4的平衡转化率越大,说明升温平衡向正反应方向移动,所以温度升高,该反应的平衡常数增大,故D错误;
故选:D。


科目:高中化学 来源: 题型:
【题目】某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A. m=2
B. 两次平衡的平衡常数相同
C. X与Y的平衡转化率之比为1:1
D. 第二次平衡时,Z的浓度为0.4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g)+3H2(g) ![]() 2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
2NH3(g) △H = -92.2 kJ/mol。下列说法不正确的是
A.1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量
B.形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量
C.加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本
D.将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL, 其pH值与溶液体积V的关系如图所示。下列说法正确的是:
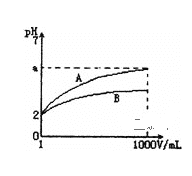
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A溶液的酸性比B溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都是弱酸,则酸性:A<B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知H-H键键能(断裂时吸收或生成时释放的能量)为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据热化学方程式:N2(g) +3H2(g) =2NH3(g) ΔH=-92.4 kJ·mol-1。则N≡N键的键能是_________。
(2)已知下列热化学方程式:
①Fe2O3(s)+3CO(g) = 2Fe(s)+3CO2(g) △H=﹣25 kJ·mol-1
②3Fe2O3(s)+CO(g) = 2Fe3O4(s)+CO2(g) △H=﹣47 kJ·mol-1
③Fe3O4(s)+CO(g) = 3FeO(s)+CO2(g) △H=﹢19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式______________。
(3)氯化铁水解的离子方程式为__________ ,配制氯化铁溶液时滴加少量盐酸的作用是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中符合下列图像的是( )

A. N2(g)+3H2(g)![]() 2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
2NH3(g) ΔH=-Q1kJ·mol-1(Q1>0)
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
2SO2(g)+O2(g) ΔH=+Q2kJ·mol-1(Q2>0)
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
4NO(g)+6H2O(g) ΔH=-Q3kJ·mol-1(Q3>0)
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
C(s)+H2O(g) ΔH=+Q4kJ·mol-1(Q4>0)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)己达到平衡状态的是
C(g)+D(g)己达到平衡状态的是
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体的总物质的量⑤混合气体的平均相对分子质量⑥C、D的分子数之比为1 : 1
A.①③④⑤B.①③⑤C.①③④⑥D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,在大脑内传递兴奋的信息,其分子结构如下所示。下列关于多巴胺的说法不正确的是

A. 分子式为C8H11NO2
B. 能与醛类物质发生缩聚反应
C. 既能与酸反应,又能与碱反应
D. 1mol该物质最多能与2mol Br2发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组从市场上买来一瓶某品牌食用白醋(主要是醋酸的水溶液),用实验室标准NaOH溶液对其进行滴定以测定它的准确浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
(1)该实验应选用 作指示剂。
(2)下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;反应达滴定终点时的现象为 。

(3)为减小实验误差,该同学一共进行了三次实验,假设每次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积;
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液;
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗;
D.锥形瓶预先用食用白醋润洗过;
E.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定。
(4)根据所给数据,写出计算该白醋中醋酸的物质的量浓度的表达式(不必化简):C= mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com