
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL, 其pH值与溶液体积V的关系如图所示。下列说法正确的是:
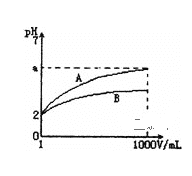
A.A、B两酸溶液的物质的量浓度一定相等
B.稀释后,A溶液的酸性比B溶液强
C.a=5时,A是强酸,B是弱酸
D.若A、B都是弱酸,则酸性:A<B
科目:高中化学 来源: 题型:
【题目】甲醚是一种淸洁燃料,以![]() =2的比例将混合气体通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)
=2的比例将混合气体通入1L的反应器中,一定条件下发生反应:2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
CH3OCH3(g)+H2O(g) △H,其CO的平衡转化率随温度、压强变化关系如图所示,下列说法正确的是
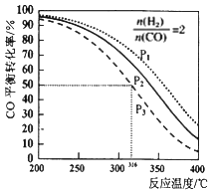
A. 上述反应△H<0
B. 图中P1<P2<P3
C. 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆)
D. 若在P3和316℃时,起始时![]() =3,则达到平衡时,CO转化率小于50%
=3,则达到平衡时,CO转化率小于50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成甲醇的反应2H2(g)+CO(g)![]() CH3OH(g) △H= -90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H= -90.8kJ,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
物质 | H2 | CO | CH3OH |
浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(1)写出该反应的平衡常数表达式K=___________________。
(2)该时间段内反应速率v(H2)=______________。
(3)比较此时正、逆反应速率的大小:v正 ___v逆(填“>”、“<”或“=”)
(4)反应达到平衡后,保持其它条件不变,若将容器的体积扩大一倍,v正_____(填“增大”、“减小”或“不变”),v逆______(填“增大”、“减小”或“不变”),平衡向____(填“逆向”、“正向”或“不”)移动,平衡常数K____(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小。某实验小组利用如下装置合成正丁醚(其它装置均略去),发生的主要反应为:2C3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
实验过程如下:在容积为100mL的三颈烧瓶中将5mL浓硫酸、14.8g正丁醇和几粒沸石混合均匀,再加热回流一段时间,收集到粗产品,精制得到正丁醚.回答下列问题:

(1)合成粗产品时,液体试剂加入顺序是___________________.
(2)实验中冷凝水应从__________口出去(填“a”或“b”).
(3)为保证反应温度恒定在135℃,装置C中所盛液体必须具有的物理性质为___________.
(4)加热时间过长或温度过高,反应混合液会变黑,写出用NaOH溶液吸收有毒尾气的离子方程式__________.
(5)得到的正丁醚粗产品依次用8mL 50%的硫酸、10mL水萃取洗涤.该步骤中需要的属于硅酸盐材质的实验仪器是烧杯、玻璃棒、_____________.该仪器使用前需要_______________________.
(6)将分离出的有机层用无水氯化钙干燥,过滤后再进行___________(填操作名称)精制得到正丁醚.
(7)本实验最终得到6.50g正丁醚,则正丁醚的产率是_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列四个图象的说法中不正确的是![]()

A.图![]() 表示可逆反应:
表示可逆反应:![]()
B.图![]() 表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体
表示用惰性电极电解足量氯化钠溶液.一段时间后,两极上可收集到相等体积的气体
C.图![]() 表示可逆反应:
表示可逆反应:![]()
D.图![]() 表示压强对可逆反应
表示压强对可逆反应![]() 的影响,乙压强大
的影响,乙压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
① 称量1.000 g样品溶于水,配成250 mL溶液;
② 准确量取25.00 mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④ 用0.1000 mol/L 的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | |
滴定前读数 | 滴定后读数 | ||
1 | 25.00 | 0.50 | 20.60 |
2 | 25.00 | 6.00 | 26.00 |
3 | 25.00 | 1.10 | 21.00 |
请回答:
(1)用_______滴定管(填“酸式”或“碱式”)盛装0.1000 mol/L的盐酸标准液。
(2)判断滴定终点到达时的现象_________。
(3)该滴定过程的滴定曲线是下列的______(选填“a”、“b”)。
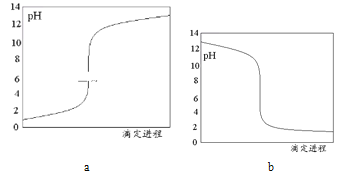
(4)若出现下列情况,测定结果偏高的是__________。
a 滴定前用蒸馏水冲洗锥形瓶
b 在振荡锥形瓶时不慎将瓶内溶液溅出
c 若在滴定过程中不慎将数滴酸液滴在锥形瓶外
(5)通过计算可知该烧碱样品的纯度为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】11、浓度均为 ![]() 的
的![]() 和
和 ![]() ,在一定条件下发生反应
,在一定条件下发生反应![]()
![]()
![]() ,测得
,测得![]() 的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是
的平衡转化率与温度及压强的关系如图所示。下列说法不正确的是

A.平衡时CO与![]() 的物质的量比为
的物质的量比为![]()
B.![]() 由大到小的顺序为
由大到小的顺序为 ![]()
C.![]() , p
, p![]() 条件下,该反应
条件下,该反应![]() 时达到平衡点X,则
时达到平衡点X,则 ![]()
D.随着温度升高,该反应的平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,有下列四种溶液:
① | ② | ③ | ④ |
0.1 mol·L-1氨水 | pH=11氨水 | 0.1 mol·L-1盐酸 | pH=3盐酸 |
下列说法中正确的是( )
A. ①稀释到原来的100倍后,pH与②相同
B. 等体积①③混合、等体积②④混合所得的溶液都呈酸性
C. ①②中分别加入少量CH3COONa固体,![]() 的值都变小
的值都变小
D. ③④稀释到原来的100倍后,稀释后④溶液中的pH大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2SO2(g)+O2(g) ![]() 2SO3(g)在一容积为2L的密闭容器中进行,试回答:
2SO3(g)在一容积为2L的密闭容器中进行,试回答:
(1)若要加快该反应的反应速率,可采取的措施有____________________、___________________。
(2)开始时,SO2的浓度是2mol/L,O2的浓度是4mol/L,2min内,SO2的浓度减少0.8mol/L,则v(SO2)=_____________。在2min末,SO3的浓度是_______________,O2的浓度是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com