
【题目】下列关于矿物油(汽油、煤油、柴油等)的判断正确的是
A. 都是烃的衍生物 B. 都有固定沸点
C. 都易溶于水 D. 都不能与氢氧化钠溶液反应
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种常见的强氧化剂,能氧化硫酸亚铁、盐酸等物质。某兴趣小组模拟企业处理含铬废水(主要含Cr2O72-和Cr3+),同时获得重铬酸钾晶体的流程如下:
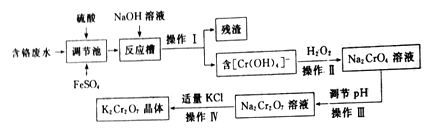
回答下列问题:
(1)操作I是______,残渣的主要成分是______。
(2)调节池中发生的主要反应的离子方程式为__________________。
(3)操作Ⅲ__________(填“能”或“不能”)用盐酸调节溶液pH,原因是___________。
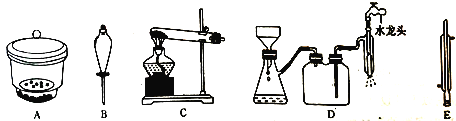
(4)从Na2Cr2O7溶液中获得K2Cr2O7晶体的操作依次是加入适量KCl固体,搅拌、溶解,在水浴上加热浓缩至________时停止加热。接下来获得K2Cr2O7晶体需要的一系列操作中,下列仪器可能会用到的是__________(填标号)。
(5)为检测处理后废水是否达到排放标准,某同学进行了如下实验:取100mL处理后的废液样品于锥形瓶中,用浓醋酸调节pH=5并加入适量固体抗坏血酸,使Cr2O72-完全转化为Cr2+,再用cmol· L-1的EDTA(用H4Y表示)标准溶液进行滴定,其反应原理为:Cr3++Y4-=CrY-,若实验消耗EDTA标准溶液VmL,则处理后的废液中含铬元素浓度为______mg·L-1(用含c、V的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱琉可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:

天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是___________________,氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是_________________。
(2)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:

①“吸收装置”中发生反应的离子方程式_____________________。
②上述流程中循环利用的物质是____________________。
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。

①通入空气吹出Br2,并用Na2CO3吸收的目的是______________________;
②反应③中每生成3molBr2,转移电子的物质的量为__________mol;
③为了除去工业Br2中微量的C12,可向工业Br2中_____________(填字母)。
a.通入HBr b.加入NaBr溶液
c.加入Na2CO3溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、 Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁:
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是__________________;
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是_____________(填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K存在下图转化关系,其中气体D、E为单质,试回答:
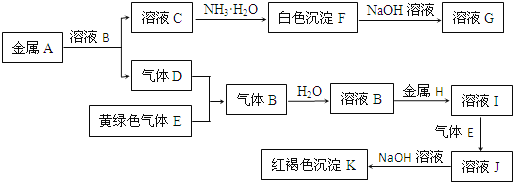
(1)写出下列物质的化学式:
A是_______________,D是___________ ,K是_______________。
(2)写出反应“C→F”的离子方程式: _______________________ 。
(3)写出反应“F→G”的化学方程式:_______________。
(4)在溶液I中滴入NaOH溶液,可观察到的现象是__________________。
(5)实验室检验溶液B中阴离子的方法是:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化氢(PH3)是一种无色剧毒气体,沸点为-89.7℃,易自燃,与空气混合爆炸,微溶于水。其制取原理类似于实验室制氨气,现用下图装置来制取磷化氢并验证其性质。
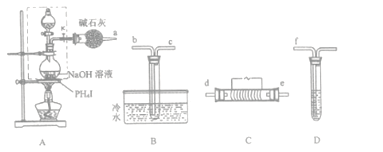
实验开始时,先从分液漏斗向盛有PH4I的圆底烧瓶中加入过量乙醚(无色液体,沸点34.5℃,微溶于水,不与Fe2(SO4)3反应),微热数分钟后再从分液漏斗向圆底烧瓶中加入一定量的浓NaOH溶液继续加热。在装置C处用电热器控制温度在300℃左右,实验过程中可观察到:B装置的试管中有白色蜡状固体生成;D装置的试管中Fe2(SO4)3溶液颜色由棕黄色变成淡绿色,同时也有白色蜡状固体生成。请回答:
(1)按气流方向连接装置,从左到右的顺序为:
a→______→ → → →f
(2)检查A中虚线框内装置的气密性的方法是____
(3)用PH4I和烧碱反应制取PH3的化学方程式是_____________。
(4)实验开始时,先向圆底烧瓶中加入乙醚并微热数分钟,其目的是__________。
(5)装置C中反应的化学方程式是____________;装置D中反应的离子方程式是_____________。
(6)装置B、D中的现象说明PH3具有的化学性质是_________(填字母序号)。
A.碱性 B.不稳定性 C.还原性 D.酸性
(7)实验时处理尾气的方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。

(1)如图中仪器①的名称是__________________。
(2)现需配制250 mL 0.200 mol·L-1NaCl溶液,如图是某同学转移溶液的示意图,装置中存在的错误是________________________
(3)下列说法中正确的是 ______________________。
A.如图中冷却水从b处流出
B.溴水中提取溴:加入萃取剂后,塞上玻璃塞,如图所示用力振摇
C.如图静置分层后,先放出下层液体,然后继续从下口放出上层液体置于另一烧杯中
D.若按如图放置温度计,会导致收集到的产品中混有低沸点的杂质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com