
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| B. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| C. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}CO_{3}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 | |
| D. | 混合物$\stackrel{加水}{→}$溶液$→_{足量}^{K_{2}SO_{4}溶液}$$\stackrel{过滤}{→}$滤液$→_{足量}^{HNO_{3}溶液}$$\stackrel{蒸发结晶}{→}$KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
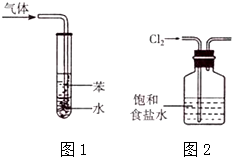
| A. | 用pH试纸测量新制氯水的pH | |
| B. | 用量筒量取 20mL 0.5000mol•L-1 H2SO4溶液于烧杯中,加水80mL,配制成0.1000mol•L-1H2SO4溶液 | |
| C. | 图1所示装置可用于吸收NH3或HC1气体,并防止倒吸 | |
| D. | 实验室用图2所示装置除去Cl2中的少量HC1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
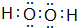 .写出甲的一种用途作高能燃料.
.写出甲的一种用途作高能燃料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 活性炭/mol | NO/mol | A/mol | B/mol | |
| 起始状态 | 2.030 | 0.100 | 0 | 0 |
| 2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
 (4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com