
| A、CO2分子的空间结构是直线形,故CO2分子是非极性分子 |
| B、分子CO和N2的原子总数相同,价电子总数相等,故性质相同 |
| C、Na+的电子排布式为1s22s22p63s1 |
| D、在元素周期表中,s区,d区和ds区的元素都是金属 |


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
| A、0.5L该溶液中钠离子的物质的量浓度为0.05mol/L |
| B、1L该溶液中含有Na2CO3的质量为10.6g |
| C、从1L该溶液中取出100mL,则取出溶液中Na2CO3的物质的量浓度为0.1mol/L |
| D、取该溶液10mL,加水稀释至100mL后,Na2CO3的物质的量浓度为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将氯气溶于水:Cl2+H2O═2H++Cl-+ClO- |
| B、AlCl3溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
| C、FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
| D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
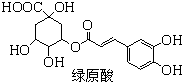 绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )
绿原酸是一种有降压作用的药物,可由咖啡酸(一种芳香酸)与奎尼酸通过酯化反应合成.下列说法正确的是( )| A、奎尼酸分子式为C9H8O4 |
| B、1mol奎尼酸与NaOH溶液反应,最多消耗5mol NaOH,1mol绿原酸与Br2水反应,最多消耗6mol Br2 |
| C、绿原酸能发生取代、加成、消去和还原反应 |
| D、咖啡酸和奎尼酸都能与FeCl3溶液发生显色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水存放在带玻璃塞的无色细口瓶中 |
| B、镁条保存在细口瓶中密闭保存 |
| C、氢氧化钠固体保存在带橡胶塞的广口瓶中 |
| D、少量金属钠保存在煤油、四氯化碳等有机溶剂中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若增加CO的用量,上式中的△H增大 |
| B、若容器内压强不随时间变化,则可以判断该反应已达到化学平衡状态 |
| C、若升高温度,则正反应速率加快,逆反应速率减慢,化学平衡正向移动 |
| D、达到化学平衡状态时,若c(CO)=0.100 mol/L,则c(CO2)=0.0263 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) |
| B、将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多 |
| C、pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7 |
| D、0.2mol?L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
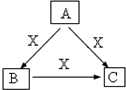 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图.请针对以下三种不同情况回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com