
【题目】连二次硝酸(H2N2O2)是二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为___。
(2)常温下,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
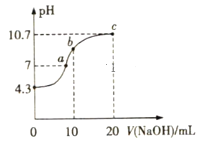
写出H2N2O2在水溶液中电离的主要方程式:___。
②c点时溶液中下列离子Na+、OH-、N2O22-、HN2O2-,浓度由大到小的顺序为___。
③b点时溶液中的溶质为___。
④a点时溶液中c(Na+)___c(HN2O2-)+c(N2O22-)(填“>”“<”或“=”)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可得到黄色的连二次硝酸银沉淀,向该体系中滴加硫酸钠溶液,白色沉淀和黄色沉淀共存时,该体系中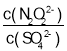 =___[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
=___[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5].
【答案】+1 H2N2O2![]() HN2O2-+ H+ c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-) NaHN2O2 > 3.0×10-4
HN2O2-+ H+ c(Na+)>c(N2O22-)>c(OH-)>c(HN2O2-) NaHN2O2 > 3.0×10-4
【解析】
连二次硝酸(H2N2O2)是二元酸,用0.01mol·L-1NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,消耗10mLNaOH时,溶质为NaHN2O2,即b点溶质为:NaHN2O2,消耗20mLNaOH时,溶质为Na2N2O2,即c点溶质为:Na2N2O2。
![]() 分子中H的化合价为
分子中H的化合价为![]() ,O元素的化合价为
,O元素的化合价为![]() ,设N元素的化合价为x,根据总化合价之和为0可知:
,设N元素的化合价为x,根据总化合价之和为0可知:![]() ,解得:
,解得:![]() ,即N元素的化合价为
,即N元素的化合价为![]() ,故答案为:
,故答案为:![]() ;
;![]() 由分析和滴定曲线可知,c点溶质为:Na2N2O2,显碱性,说明N2O22-会水解,
由分析和滴定曲线可知,c点溶质为:Na2N2O2,显碱性,说明N2O22-会水解,![]() 为二元弱酸,在水溶液中的电离方程式为:
为二元弱酸,在水溶液中的电离方程式为:![]() ,故答案为:
,故答案为:![]() ;
;![]() 点滴入20mL相同浓度的NaOH溶液,反应后溶质为
点滴入20mL相同浓度的NaOH溶液,反应后溶质为![]() ,所以
,所以![]() 部分水解产生
部分水解产生![]() :
:![]() +H2O
+H2O![]()
![]() +OH-,由于
+OH-,由于![]() 还要水解产生OH-,所以
还要水解产生OH-,所以![]() ,溶液中离子浓度大小为:
,溶液中离子浓度大小为:![]() ,故答案为:
,故答案为:![]() ;
;![]() 由上面分析可知,b点溶质为NaHN2O2,故答案为:NaHN2O2;
由上面分析可知,b点溶质为NaHN2O2,故答案为:NaHN2O2;
④溶液中的电荷守恒式子为:c(Na+)+c(H+)=c(HN2O2-)+2c(N2O22-)+c(OH-),a点pH=7,溶液显中性,有c(H+)= c(OH-),所以c(Na+)=c(HN2O2-)+2c(N2O22-),所以c(Na+)>c(HN2O2-)+c(N2O22-),故答案为:>;
![]() 当两种沉淀共存时,溶液中存在两种沉淀溶解平衡,所以
当两种沉淀共存时,溶液中存在两种沉淀溶解平衡,所以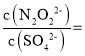
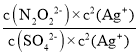 =
=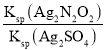
![]() ,故答案为:
,故答案为:![]() 。
。


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是

A. 绿原酸属于芳香族化合物
B. 分子中至少有 7 个碳原子共面
C. 1mol 绿原酸最多可消耗 5mol NaOH
D. 与绿原酸苯环上取代基种类及个数均相同的有机物有5 种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家们合成了一种新物质——五星烷,其键线式如图所示。下列有关五星烷的说法正确的是( )

A. 五星烷与乙烷互为同系物 B. 五星烷的化学式为C15H20
C. 五星烷的分子中含有7个五元环 D. 五星烷的一氯代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是( )
A.该反应的ΔH>0,ΔS<0
B.每生成1molN2H4转移2mol电子
C.室温下,向0.1mol·L-1NaClO溶液中加水,溶液pH减少
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为N2H4-4e-=N2+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物W的结构简式为![]() 下列有关W的说法错误的是
下列有关W的说法错误的是
A.是一种酯类有机物B.含苯环和羧基的同分异构体有3种
C.所有碳原子可能在同一平面D.能发生取代、加成和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地沟油泛指在生活中存在的各类劣质油,如回收的食用油、反复使用的炸油等。地沟油最大来源为城市大型饭店下水道的隔油池。长期食用可能会引发癌症,对人体的危害极大。根据以上信息和相关知识回答下列问题:
(1)下列说法正确的是__(填序号)。
A.掺假的“芝麻香油”(含有油酸甘油酯)能使溴水和酸性KMnO4溶液褪色,褪色原理相同
B.淀粉和油脂都是高分子化合物
C.地沟油可用来制肥皂
D.纤维素的最终水解产物与油脂水解产生的甘油含有某种相同的官能团
(2)地沟油中常常含有油酸甘油酯,在微生物作用下油酸甘油酯水解生成的不饱和脂肪酸中的碳碳双键在日光作用下被空气中的氧气氧化生成有臭味的醛或酮,这种过程称为“酸败”。
①试写出油酸甘油酯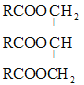 (—R为(CH3(CH2)7CH=CH(CH2)6CH2—)“酸败”过程中水解的化学方程式:__。
(—R为(CH3(CH2)7CH=CH(CH2)6CH2—)“酸败”过程中水解的化学方程式:__。
②工业上为了延缓不饱和油脂的“酸败”,通常采取的一种措施是在Ni催化作用下使油酸甘油酯与H2发生加成反应,1mol油酸甘油酯最多消耗__molH2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗高磷酸盐血症。某化学小组用如图装置模拟制备碳酸镧,反应为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O下列说法正确的是
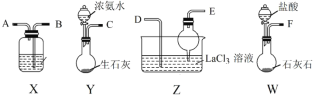
A.从左向右接口的连接顺序:F→B,A→D,E←C
B.装置X中盛放的试剂为饱和Na2CO3溶液
C.实验开始时应先打开W中分液漏斗的旋转活塞
D.装置Z中用干燥管的主要目的是增大接触面积,加快气体溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年10月9日,瑞典皇家科学院将2019年度诺贝尔化学奖授予美国JohnBGoodenough教授、M.stanleyWhittlingham教授和日本化学家AkiraYoshino,以表彰其在锂离子电池的发展方面作出的贡献。
(1)基态锂原子核外能量最高的电子所处能级的电子云轮廓图的形状为___;基态磷原子第一电离能比硫的___ (填“大”或“小”),原因是___。
(2)实室中可用KSCN或K4[Fe(CN)6]来检验Fe3+,FeCl3与KSCN溶液混合,可得到配位数为5的配合物的化学式是___;
(3)磷酸(H3PO4)和亚磷酸(H3PO3)是磷元素的两种含氧酸。PO43-的空间构型为___;亚磷酸与NaOH反应只生成NaHPO3和NaH2PO3两种盐,则H3PO3的结构式为___。
(4)磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示:
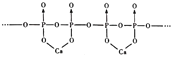
由图推知该多磷酸钙盐的通式为__(用n表示重复单元数)
(5)氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与O2-紧邻且等距离的Fe2+数目为__;Fe2+与O2-最短核间距为___pm。
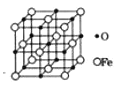
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com