
【题目】2017年5月18日中共中央国务院公开致电祝贺南海北部神狐海域进行的“可燃冰”试采成功。“可燃冰”是天然气水合物,外形像冰,在常温常压下迅速分解释放出甲烷,被称为未来新能源。
(1)“可燃冰”作为能源的优点是__________(回答一条即可)。
(2)甲烷自热重整是先进的制氢方法,包含甲烷氧化和蒸汽重整两个过程。向反应系统同时通入甲烷,氧气和水蒸气,发生的主要化学反应如下:
反应过程 | 化学方程式 | 焓变△H(kJ.mol-l) | 活化能E.(kJ.mol-1) |
甲烷氧化 | CH4(g)+O2(g) | -802.6 | 125.6 |
CH4(g)+O2(g) | -322.0 | 172.5 | |
蒸气重整 | CH4(g)+H2O(g) | +206.2 | 240.1 |
CH4(g)+2H2O(g) | +158.6 | 243.9 |
回答下列问题:
①在初始阶段,甲烷蒸汽重整的反应速率______(填“大于”“小于”或“等于”)甲烷氧化的反应速率。
②反应CH4(g)+H2O(g)![]() CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。
CO(g)+3H2(g)的平衡转化率与温度、压强关系[其中n(CH4):n(H2O)=1:1]如图所示。

该反应在图中A点的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数),图中压强(p1、p2、p3、p4)由大到小的顺序为___________。
③从能量角度分析,甲烷自热重整方法的先进之处在于___________。
④如果进料中氧气量过大,最终会导致H2物质量分数降底,原因是__________。
(3)甲烷超干重整CO2技术可得到富含CO的气体,其能源和开境上的双重意义重大,甲烷超干重整CO2的催化转化原理如图所示。

①过程II中第二步反应的化学方程式为_____________。
②只有过程I投料比![]() _______,过程II中催化剂组成才会保持不变。
_______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方式为______________。
【答案】 能量密度高、清洁、污染小、储量大 小于 ![]() (Mpa)2或0.1875(Mpa)2 p1>p2>p3>p4 甲烷氧化反应放出热量正好洪蒸汽重整反应所吸收自热量,达到能量平衡 氧气量过大,会将H2氧化导致H2物质量分数降低 3Fe+4CaCO3
(Mpa)2或0.1875(Mpa)2 p1>p2>p3>p4 甲烷氧化反应放出热量正好洪蒸汽重整反应所吸收自热量,达到能量平衡 氧气量过大,会将H2氧化导致H2物质量分数降低 3Fe+4CaCO3![]() Fe3O4+4CaO+4CO↑ 1/3 CH4(g)+ 3CO2(g)
Fe3O4+4CaO+4CO↑ 1/3 CH4(g)+ 3CO2(g)![]() 2H2O(g) +4CO(g) △H=+349kJ/mol
2H2O(g) +4CO(g) △H=+349kJ/mol
【解析】(1). “可燃冰”分子结构式为:CH4·H2O,是一种白色固体物质,外形像冰,有极强的燃烧力,可作为上等能源。它主要由水分子和烃类气体分子(主要是甲烷)组成,所以也称它为甲烷水合物,它的优点:能量密度高、清洁、污染小、储量大等;正确答案:能量密度高、清洁、污染小、储量大。
(2)①从表中活化能数据看出在初始阶段,甲烷蒸汽重整反应活化能较大,而甲烷氧化的反应活化能均较小,所以甲烷氧化的反应速率快;正确答案:小于。
② 根据题给信息,假设甲烷有1mol, 水蒸气有1mol,
CH4(g)+ H2O(g)![]() CO(g)+ 3H2(g)
CO(g)+ 3H2(g)
起始量 1 1 0 0
变化量 0.2 0.2 0.2 0.6
平衡量 0.8 0.8 0.2 0.6
平衡后混合气体的总量:0.8+0.8+0.2+0.6=2.4 mol;各物质分压分别为:p(CH4)=p(H2O)=4×0.8÷2.4=4/3,p(C0)= 4×0.2÷2.4=1/3, p(H2)=4×0.6÷2.4=1,A点的平衡常数Kp=13×1/3÷(4/3)2=3/16;根据图像分析,当温度不变时,压强减小,平衡左移,甲烷的转化率增大,所以压强的大小顺序:p1>p2>p3>p4;正确答案3/16;p1>p2>p3>p4。
③甲烷氧化反应放出热量正好提供给甲烷蒸汽重整反应所吸收热量,能量达到充分利用;正确答案:甲烷氧化反应放出热量正好洪蒸汽重整反应所吸收自热量,达到能量平衡。
④氧气量过大,剩余的氧气会将H2氧化为水蒸气,会导致H2物质量分数降低;正确答案:氧气量过大,会将H2氧化导致H2物质量分数降低。
(3)①根据图示分析,第一步反应是还原剂把四氧化三铁还原为铁,第二步反应是铁被碳酸钙氧化为四氧化三铁,而本身被还原为一氧化碳;正确答案:3Fe+4CaCO3![]() Fe3O4+4CaO+4CO↑。
Fe3O4+4CaO+4CO↑。
②反应的历程:①CH4(g)+ CO2(g)![]() 2H2(g) +2CO(g);②Fe3O4(s)+4H2
2H2(g) +2CO(g);②Fe3O4(s)+4H2![]() 3Fe(s)+4H2O(g); ③Fe3O4(s)+4 CO(g)
3Fe(s)+4H2O(g); ③Fe3O4(s)+4 CO(g)![]() 3Fe(s)+4 CO2(g);三个反应消去Fe3O4和Fe,最终得到CH4(g)+ 3CO2(g)
3Fe(s)+4 CO2(g);三个反应消去Fe3O4和Fe,最终得到CH4(g)+ 3CO2(g)![]() 2H2O(g) +4CO(g);所以只有过程I投料比
2H2O(g) +4CO(g);所以只有过程I投料比![]() 1/3时,才能保证II中催化剂组成保持不变;正确答案:1/3。
1/3时,才能保证II中催化剂组成保持不变;正确答案:1/3。
③ ①CH4(g)+3/2O2(g)![]() CO(g)+2H2O(g) △H1=-802.6 kJ.mol-l;
CO(g)+2H2O(g) △H1=-802.6 kJ.mol-l;
②CH4(g)+O2(g)![]() CO2(g)+2H2(g) △H2=-322.0 kJ.mol-l;
CO2(g)+2H2(g) △H2=-322.0 kJ.mol-l;
③CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) △H3=+158.6 kJ.mol-l;
CO2(g)+4H2(g) △H3=+158.6 kJ.mol-l;
②×1.5-①得方程式⑤:1/2 CH4(g)+ CO(g)+ 2H2![]() 2H2O(g) +4CO(g),△H=+349kJ/mol;正确答案:CH4(g)+ 3CO2(g)
2H2O(g) +4CO(g),△H=+349kJ/mol;正确答案:CH4(g)+ 3CO2(g)![]() 2H2O(g) +4CO(g),△H=+349kJ/mol。
2H2O(g) +4CO(g),△H=+349kJ/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】萘及其取代物是重要的有机合成材料和药物中间体。实验室由芳香化合物A和烃B制备1-乙基萘(M)的一种合成路线如下:

已知:Ⅰ.B的核磁共振氢谱中有2组吸收峰
Ⅱ. 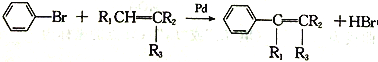 (R1、R2、R3表示H原子或烃基)
(R1、R2、R3表示H原子或烃基)
Ⅲ. 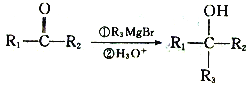 (R1、R2、R3表示H原子或烃基)
(R1、R2、R3表示H原子或烃基)
请回答下列问题:
(1)A的化学名称为________________,,B的结构简式为________________________。
(2)B→C的反应类型为_______________________。
(3)D的分子式为_____________________,F中官能团的名称为_______________________。
(4)G→H的化学方程式为_____________________________。
(5)含有萘环的M的同分异构体还有_______种;其中核磁共振氯谱为四组峰的结构简式_________(任写一种)。
(6)参照上述合成路线和信息,以丙酮和溴苯为原料(其他无机试剂任选),设计制备![]() 的合成路线_______________________________________。
的合成路线_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒电池以惰性材料作电极,在电解质溶液中发生的电池总反应为:
VO2+(蓝色)+H2O+V3+(紫色)![]() VO2+(黄色)+V2+(绿色)+2H+
VO2+(黄色)+V2+(绿色)+2H+
下列说法错误的
A. 充电时,反应每生成2mol H+时电子转移的物质的量为2mol
B. 放电过程中,正极附近溶液的酸性减弱
C. 放电时,正极反应为VO2++2H++e-=VO2++H2O
D. 充电时,阳极附近溶液由蓝色逐渐变为黄色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A为烃类化合物,质谱图表明其相对分子质量为70,其相关反应如下图所示,其中B、D、E的结构中均含有2个-CH3,它们的核磁共振氢谱中均出现4个峰。
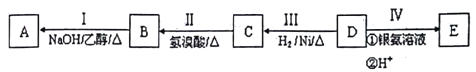
请回答:
(1)D的分子式为______;
(2)B中所含官能团的名称为_______;
(3)Ⅲ的反应类型为_______(填字丹序号);
a. 还原反应 b.加成反应 c.氧化反应 d.消去反应
(4)写出下列反应的化学方程式:
I:_____________________________;
C和E可在一定条件下反应生成F,F为有香味的有机化合物,该反应的化学方程式为______________________________________;
(5)A的同分异构体中有一对互为顺反异构,且结构中有2个-CH3,它们的结构简式为_____和__________________________;
(6)E有多种同分异构体,其中含有![]() 结构的有________种;(不包括E)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为_______。
结构的有________种;(不包括E)E的另一种同分异构体能发生银镜反应,能与足量金属钠生成氢气,不能发生消去反应,其结构简式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁和石墨作电极电解酸性废水,可将废水中的PO43-以FePO4(不溶于水)的形式除去,其装置如图所示。
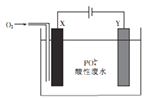
下列说法正确的是
A. 若X、Y电极材料连接反了,则仍可将废水中的PO43-除去
B. X极为石墨,该电极上发生氧化反应
C. 电解过程中Y极周围溶液的pH减小
D. 电解时废水中会发生反应:4Fe2++02-4H++4P043-=4FePO4↓+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图一所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液,足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。
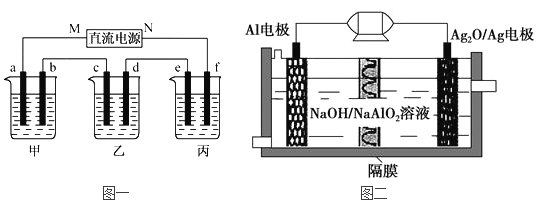
(1)图一中的直流电源为一种性能优良的Al-Ag2O电池,其原理如图二所示。该电池中铝是负极,试写出电池工作时的正极反应式__________________和电池的总化学反应方程式______________。
(2)接通电源后,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为_______极;c电极上发生______反应(“氧化”或“还原”);
②电极b上发生的电极反应为___________________;
③列式计算电极b上生产的气体在标准状况下的体积_______;
④电极c的质量变化是_____g;
⑤电解前后各溶液的pH是否发生变化(“增大”、“减小”或“不变”)
甲溶液_________;乙溶液_________;丙溶液______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。

完成下列各题:
(1)正四面体烷的分子为_________,其二氯取代产物有_______种。
(2)关于乙烯基乙炔分子的说法错误的是:____________。
a.能使酸性KMnO4溶液褪色
b.乙烯基乙炔分子内含有两种官能团
c.1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
d.等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃(含有苯环的烃)的分子的结构简式:_________________________________________。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):_______、_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】描述下列反应的现象并写出反应的离子方程式。
(1)向FeCl3溶液中滴加NaOH溶液,现象:__________________,离子方程式:____________________。
(2)向NaHCO3溶液中滴加稀H2SO4,现象:__________________,离子方程式:____________________。
(3)稀HNO3和Ba(OH)2溶液混合,现象:__________________,离子方程式:______________________。
(4)比较:上述三个离子反应发生的条件的不同点是__________________;相同点是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com