
| A、水解反应 | B、加聚反应 |
| C、加成反应 | D、氧化反应 |
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
 X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):
X、Y、Z均是由两种短周期元素组成的无机物,它们的每个分子中均含有l8个电子,相关信息如下表所示(“/”表示相应的信息略去):| 化合物 | X | Y | Z |
| 分子中含有的原子个数 | / | 4 | / |
| 摩尔质量/g?mol-l | 32 | 34 | / |
 ,则X的化学式为
,则X的化学式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28g乙烯所含共用电子对数目为4NA |
| B、0.5mol 1,3-丁二烯分子中含有C=C双键数为NA |
| C、1 mol羟基所含的电子总数为10NA |
| D、标准状况下,11.2 L己烷所含分子数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时负极反应为:3Zn+6e-+6OH-═3Zn(OH)2 |
| B、放电时OH-向负极移动 |
| C、充电时每转移3mol电子,阳极有1mol Fe(OH)3被还原 |
| D、充电时阴极反应式为:3Zn(OH)2+6e-+6H+═3Zn+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
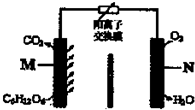 一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )
一种新型污水处理装置如图所示.该装置可利用一种微生物将有机废水的化学能直接转化为电能.下列说法中不正确的是( )| A、电池工作时H+从M极区移向N极区 |
| B、N极为正极,发生还原反应 |
| C、M极的电极反应式为:C6H12O6+6H2O-24e-═6CO2↑+24H+ |
| D、当N极消耗5.6L(标况下)气体时,则有2NA个H+通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化钠溶于稀硝酸:S2-+2H+═H2S↑ |
| B、草酸使酸性高锰酸钾褪色:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O |
| C、FeI2溶液中通入少量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| D、硫酸铝溶液中加入过量氨水:Al3++3NH3?H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验剩余的药品一般不能放回原试剂瓶 |
| B、溶解时用玻璃棒搅拌 |
| C、可燃性气体点燃前必须验纯 |
| D、过滤时玻璃棒靠在三层滤纸处 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断减小 |
| B、常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7 |
| C、水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
| D、0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com