
����Ŀ���о�SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1�������Ƽ�ѭ�������ѳ������е�SO2�����Ƽ�ѭ�����У���Na2SO3��Һ��Ϊ����Һ����SO2�Ĺ����У�pH��n��SO![]() ����n��HSO
����n��HSO![]() ���仯��ϵ���±���
���仯��ϵ���±���
n��SO | 91��9 | 1��1 | 9��91 |
pH | 8��2 | 7��2 | 6��2 |
�����ϱ��жϣ�NaHSO3��Һ��____________�ԣ���ƽ��ԭ�����ͣ�_____________________��
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ������ѡ����ĸ��___________________��
a��c��Na������2c��SO![]() ����c��HSO
����c��HSO![]() ��
��
b��c��Na����>c��HSO![]() ��>c��SO
��>c��SO![]() ��>c��H������c��OH����
��>c��H������c��OH����
c��c��Na������c��H������c��SO![]() ����c��HSO
����c��HSO![]() ����c��OH����
����c��OH����
��2����ij��Һ�к�3mol Na2SO3������һ������ϡ���ᣬǡ��ʹ��Һ��Cl����HSO![]() �����ʵ���֮��Ϊ2��1��������������HCl�����ʵ�������_____________mol��
�����ʵ���֮��Ϊ2��1��������������HCl�����ʵ�������_____________mol��
��3��CO�����ںϳ�CH3OH����Ӧ����ʽΪ��CO��g��+2H2��g��![]() CH3OH��g�� ,��һ���¶�ѹǿ�£����ݻ�Ϊ2L���ܱ�������ͨ��0��2molCO��0��4molH2����ƽ��ʱCO��ת����50%������¶��µ�ƽ�ⳣ��Ϊ ���ټ���1��0molCO�����´ﵽƽ�⣬��CO��ת���� ������������䡱��С����CH3OH��������� ������������䡱��С������
CH3OH��g�� ,��һ���¶�ѹǿ�£����ݻ�Ϊ2L���ܱ�������ͨ��0��2molCO��0��4molH2����ƽ��ʱCO��ת����50%������¶��µ�ƽ�ⳣ��Ϊ ���ټ���1��0molCO�����´ﵽƽ�⣬��CO��ת���� ������������䡱��С����CH3OH��������� ������������䡱��С������
��4����0��02mol/LNa2SO4��Һ��ijŨ��BaCl2��Һ�������ϣ�������BaSO4��������ԭBaCl2��Һ����СŨ��Ϊ ������֪Ksp��BaSO4����1��1��10-10��
��5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������������Ⱦ��ʵ��������ͼװ��ģ���������̣���ԭ���ǣ�ͨ���Co2+������Co3+��Ȼ����Co3+����������ˮ�еļ״�������CO2��������Co3+�Ļ�ԭ������Co2+����
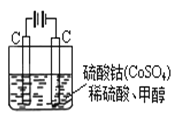
�� д�������缫��Ӧʽ�� ��
�� д����ȥˮ�еļ״������ӷ���ʽ�� ��
���𰸡���1��������1����HSO![]() �ĵ���̶�ǿ��ˮ��̶���1������ab��2����
�ĵ���̶�ǿ��ˮ��̶���1������ab��2����
��2��4��2������3��100L2/mol2��2��������1��������1����
��4��2��2��10-8mol/L��2����
��5����Co2+��e����Co3+��6Co3++CH3OH+H2O��CO2��+6Co2++6H+����2����
��������
�����������1�����������ɱ����е����ݿ�֪��HSO3-Խ�࣬����Խǿ����������������ӣ����뷽��ʽΪHSO3-H++SO32-����������������������ˮ����������Һ������ʱ������Ϊ�������ƺ����������ƣ�������ˮ��ij̶���ȣ���ϵ���غ���A��c��Na����+C��H+����2c��SO![]() ����c��HSO
����c��HSO![]() ��+C��OH-����C��H+��=C��OH-��,��c��Na������2c��SO
��+C��OH-����C��H+��=C��OH-��,��c��Na������2c��SO![]() ����c��HSO
����c��HSO![]() ����SO32-+H2OHSO3-+OH-��HSO3-H++SO32-������������ˮ�⣬������Ũ��Ϊc��Na+����c��HSO3-����c��SO32-����c��H+��=c��OH-����b��ȷ�� c��c��Na������c��H������c��SO
����SO32-+H2OHSO3-+OH-��HSO3-H++SO32-������������ˮ�⣬������Ũ��Ϊc��Na+����c��HSO3-����c��SO32-����c��H+��=c��OH-����b��ȷ�� c��c��Na������c��H������c��SO![]() ����c��HSO
����c��HSO![]() ����c��OH���������ϵ���غ㣬c������
����c��OH���������ϵ���غ㣬c������
��2��Na2SO3+HCl=NaCl+NaHSO3 NaHSO3+HCl=NaCl+H2O+SO2��
1 1 1 1 1 1 1
3mol X X X Y Y Y
X=3mol������Cl����HSO![]() �����ʵ���֮��Ϊ2��1���з��� ��X+Y��:��X-Y��=2:1 X:Y=3:1����X=3mol������ʽ��Y=1mol��������������HCl�����ʵ�������=X+Y=3+1=4mol��
�����ʵ���֮��Ϊ2��1���з��� ��X+Y��:��X-Y��=2:1 X:Y=3:1����X=3mol������ʽ��Y=1mol��������������HCl�����ʵ�������=X+Y=3+1=4mol��
��3�� CO��g��+ 2H2��g��![]() CH3OH��g����
CH3OH��g����
��ʼ 0��2mol 0��4mol 0
�仯 0.2��50% 0.4��50%
ƽ�� 0.1 0.2 0.1
����¶��µ�ƽ�ⳣ��Ϊ=0.1 /[��0.1/2�� ����0.2/2��2]= 100L2/mol2 ,���ַ�Ӧ�����CO��Ũ�ȣ���ת���ʼ��٣�����CO�����϶���ƽ�����ƣ�����COʣ��϶࣬���ɵ�CH3OH�����ȵ�һ��ƽ�����Զ�һЩ������CH3OH��ռ���������������٣��������������
��4����Һ��������,����ӱ���Ũ�ȼ��룬��BaCl2��ҺŨ��ΪC �������Ksp��BaSO4����1��1��10-10=C��Ba2+����C ��SO4��2-=0.02/2��C/2 C= 2��2��10-8mol/L
��5����ͨ�������Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+������Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+��ԭ���غ������غ��֪����ԭ����H+����ƽ��дΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����彡����������������ʮ����Ҫ�����á���ش��������⣺
(1)��θ��ҩ�������ܶ࣬����Ч�ɷ�һ�㶼��̼�����ơ�̼��ơ�̼��þ������������������þ�Ȼ�ѧ���ʡ���д��NaHCO3��Al(OH)3��θ��(��HCl��ʾ)���õĻ�ѧ����ʽ�� ��_____________��ijƷ�ƿ���ҩ����Ҫ�ɷ������¡�̼�����ơ��������������ۡ�д���ÿ���ҩ���ӹ�Чʱ�����ӷ���ʽ��___________________��__________________��
(2)��ͬѧ����ҹä֢�����ܵ�ԭ��֮һ������ȱ��ά���� (A��B��C��D�� E��K����ͬ)����ͬѧ��ˢ��ʱ����������Ѫ����ͬѧ��ƽʱӦ��Ը���ά���� ��ʳ�
(3)���Ľ�����ԱȽ�ǿ�����ڿ�����ȴ�Ƚ��ȶ�����ԭ����_________________
(4)��һ�ֿ���ҩ������Ч�ɷ���CaCO3��Ϊ�ⶨÿһƬҩƬ��CaCO3����������ȡһƬҩƬ���гɷ�ĩ�������������ᷴӦ���ռ�����״���µ�CO2����22.4mL����CaCO3���������ᷴӦ�Ļ�ѧ����ʽΪ ��ÿһƬҩƬ��CaCO3������Ϊ g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��ѧ����ʽ��������ʵ�������ȷ����
A����0.1 mol/L��pH��1��NaHA��Һ�м���NaOH��Һ��H����OH�� = H2O
B���Խ�����Ϊ������ⱥ��NaCl��Һ��2Cl����2H2O![]() H2����Cl2����2OH��
H2����Cl2����2OH��
C������������KIO3��Һ��KI��Һ������Ӧ����I2��IO3����5I����3H2O��3I2��6OH��
D��NH4Al(SO4)2��Һ�м���Ba(OH)2��ҺʹSO42����ȫ������
Al3+��2SO42����2Ba2+��4OH��= AlO2����2BaSO4����2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���������
A. ������ķ���������ˮ�Ƴ�����ˮ
B. �þƾ���ȡ��ˮ�еĵ�
C. ������ƿ��������������Һ��Ũ��
D. ����������������ɢϵ�ı��������Ƿ�ɢ������ֱ����1nm��10nm֮��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯�ƣ�NaBH4��Ϊ��ɫ��ĩ��������ˮ���⣬��������������۵㣺-101�棬�е㣺33�棩���ڸɿ������ȶ�����ʪ�����зֽ⣬�����ϳɺ��л��ϳ��г��õ�ѡ���Ի�ԭ����ij�о�С�����ƫ�����ƣ�NaBO2��Ϊ��Ҫԭ���Ʊ�NaBH4�����������£�
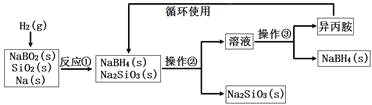
����˵������ȷ����
A��ʵ������ȡ����������Ҫ�õ���ʵ����Ʒ�����ӡ���ֽ������Ƭ��С��
B�������ڡ������۷ֱ��ǹ����������ᾧ
C����Ӧ�ټ���֮ǰ�轫��Ӧ��������100�����ϲ�ͨ�����
D����Ӧ�����������뻹ԭ�������ʵ���֮��Ϊ1��2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С������С����״����Ͻ�������ϡ����ķ�Ӧ����֪����ϡ�����Ӧ�����ⶨͨ��״����20�棬101 kPa���µ�����Ħ���������ѡ������ʵ��װ�����ʵ�飺

��1����С��ͬѧ����ѡ�õ�װ���������ӵĺ���˳��ΪA��_____________��
��2��ʵ�鿪ʼʱ���ȴ�Һ©���ϿڵIJ�����������������������ʼʱϡ�����ܵ�����ƿ�У�һ��ʱ���ϡ�����˳��������ƿ�У���ԭ����____________________��
��3����������ϡ���ᷴӦ�����ӷ���ʽΪ_________________��
��4��ʵ�����ʱ������ʵ��������H2����IJ���������_______________��
��5��ʵ����ȷ���3�����ݣ�ʵ��ǰ����Ͻ������m1g��ʵ���������������m2g��ʵ�����Ͳ��Һ�����ΪV ml������ͨ��״��������Ħ�����Vm=__________L��mol-l�����Ͻ��к�����ͭ��������õ�Vm��____________���ƫ��ƫС������Ӱ�족����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�ҵ��������Ҫ��ѧ��Ӧ���漰Ӧ����������ԭ�����п��Ƶ��� �� ��
A���ϳɰ� B�������� C�������� D���ƴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͭ�����������л������Ͷ������ǻ۵Ľᾧ����Ϊһ��ʱ��������������������ͭ������ܵ�������ʴ����ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ�������е�Cl-��ɢ���ڣ�������缫�����������ɶ��״��Cu2��OH��3Cl����˵������ȷ����
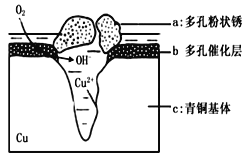
A����ʴ������,����c������
B�������е�Cl-��ɢ���ڣ�����������Ӧ���������Ӧ�����������ɶ��״��Cu2��OH��3Cl�������ӷ���ʽΪ2Cu2��+3OH��+Cl��=Cu2��OH��3Cl��
C�������� 2.145gCu2��OH��3Cl,�����������ı�״���������Ϊ 0.448L
D�������ĵ缫��ӦʽΪ:������Ӧ�� O2+ 4e��+2H2O=4OH-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����ұ���������ȡ����ϩ�ķ�Ӧ���£�
![]() ��g��
��g��![]() ��g����H2��g��
��g����H2��g��
�ֽ�x mol�ұ�����ͨ������ɱ���ܱ������з�Ӧ��ά����ϵ��ѹǿp���㶨����ij���������£��ұ���ƽ��ת�������¶ȱ仯��ͼ��ʾ��

��֪�������ѹ��p������ ������ѹ��p��������������������Ǹ���Ӧ������˵����ȷ����
A��400��ʱ������ϵ��ͨ��ˮ������v��������v������ ����С�����ұ�ת���ʽ���
B��500��ʱ������ϵ��ͨ���ұ�������ϩ��������0.1x mol��ƽ�����ƶ�
C��550��ʱ����ƽ���ѹ����ƽ��Ũ�ȱ�ʾ�Ļ�ѧƽ�ⳣ��Kp��![]() �� p��
�� p��
D��550��ʱƽ����ϵ�б���ϩ�����������450��ʱ��3��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com