
����Ŀ��A��B��C��W��Ϊ��ѧ�����Ĵ��������֮��������ת����ϵ���������P��Ӧ��������ȥ����Ӧ������ˮ��Һ�н��У���
![]()
��1����A��B��C�������ʵ���Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ�����ȷֽ��ת��ΪB��
��A�����Wת��ΪC���ܷ�Ӧ�����ӷ���ʽΪ__��
��A��Һ��C��Һ��Ӧ�Ļ�ѧ����ʽΪ__��
��2����B����Һ�Ի�ɫ��һ��������B�ı�����Һ�����ˮ��Ӧ���ɺ��ɫ��ɢϵ��
��ʵ������A���ʵķ�Ӧ�����ӷ���ʽΪ__��
��C��Һ�м�������������Һ������__��
��һ��������W��ˮ��Ӧ�Ļ�ѧ����ʽΪ___��
���𰸡�OH-+CO2=HCO3- NaOH+NaHCO3=Na2CO3+H2O MnO2+4H++2Cl-![]() Mn2++2H2O+Cl2�� ���ɰ�ɫ��������ת��Ϊ����ɫ�����ձ�Ϊ���ɫ 3Fe+4H2O(g)
Mn2++2H2O+Cl2�� ���ɰ�ɫ��������ת��Ϊ����ɫ�����ձ�Ϊ���ɫ 3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
��������
(1)��A��B��C�������ʵ���Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��C���ȷֽ��ת��ΪB������NaԪ�أ�CΪNaHCO3��BΪNa2CO3�����ͼ��ת����֪��AΪNaOH��WΪCO2��
��2����B����Һ�Ի�ɫ��һ��������B�ı�����Һ�����ˮ��Ӧ���ɺ��ɫ��ɢϵ��BΪFeCl3�����ͼ��ת����֪��AΪCl2��WΪFe��CΪFeCl2��
(1)��A��B��C�������ʵ���Һ���Լ��ԣ���ɫ��Ӧ��Ϊ��ɫ��C���ȷֽ��ת��ΪB������NaԪ�أ�CΪNaHCO3��BΪNa2CO3�����ͼ��ת����֪��AΪNaOH��WΪCO2��
��A�����Wת��ΪC���ܷ�Ӧ�����ӷ���ʽΪOH-+CO2=HCO3-
��A��Һ��C��Һ��Ӧ�Ļ�ѧ����ʽΪ NaOH+NaHCO3=Na2CO3+H2O
��2����B����Һ�Ի�ɫ��һ��������B�ı�����Һ�����ˮ��Ӧ���ɺ��ɫ��ɢϵ��BΪFeCl3�����ͼ��ת����֪��AΪCl2��WΪFe��CΪFeCl2��
��ʵ������A���ʵķ�Ӧ�����ӷ���ʽΪMnO2+4H++2Cl-![]() Mn2++2H2O+Cl2��
Mn2++2H2O+Cl2��
��C��Һ�м�������������Һ���������ɰ�ɫ��������ת��Ϊ����ɫ�����ձ�Ϊ���ɫ
��һ��������W��ˮ��Ӧ�Ļ�ѧ����ʽΪ3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���¶�ΪT ʱ����2.0 L�����ܱ������г���1.0 mol PCl5��
��Ӧ��PCl5(g)![]() PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
PCl3(g)��Cl2(g)��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ�IJ������ݼ��±���
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
����˵����ȷ����
A. ��Ӧ��ǰ50 s�ڵ�ƽ������v(PCl3)=0.0032mol/(L��s)
B. ���������������䣬�����¶ȣ�ƽ��ʱc(PCl3)=0.11mol/L���÷�ӦΪ���ȷ�Ӧ
C. ��ͬ�¶��£���ʼʱ�������г���1.0 mol PCl5��0.20 mol PCl3��0.20 mol Cl2���ﵽƽ��ǰ��v����v��
D. ��ͬ�¶��£���ʼʱ�������г���2.0 mol PCl3��2.0 mol Cl2���ﵽƽ��ʱ��PCl3��ת����С��80��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧһѡ��3:���ʽṹ������]
���������ڹ��ý�������������ҪӦ�ã�þ������ͭ�Ǽ�����Ҫ�Ľ���Ԫ�أ���ش���������:
(1)��Ԫ�صĺ˵����Ϊ28����ԭ�ӻ�̬�����Ų�ʽΪ ________ ���ṹ���� ___ �ֲ�ͬ��״�ĵ����ơ�
(2)MgO���۵����CuO��ԭ����__________________________
(3)MgԪ�صĵ�һ�����ܷ����ظ���ͬ���ں�һ��Ԫ�أ�ԭ����_____________________
(4)Ni��CO���γ������Ni(CO)4���÷����ЦҼ���м�������Ϊ _____________________
(5)�����[Cu(CH3C��N)4]BF4��̼ԭ���ӻ��������Ϊ______ ��BF4-�Ŀռ乹��Ϊ_________________ ��
(6)ͭ����Ԫ�ؿ��γ���ͼ��ʾ�ľ����ṹ������Cu���ȵط�ɢ���������ڲ���a��b�������������Ϊ(0,0,0)��(1/2��1/2��1/2)����d���������Ϊ ____________,��֪��Ʒ����ܶ�Ϊ��g/cm3,NA�ǰ����ӵ�����ֵ��������Ϊ _______________ cm(�г�����ʽ����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Mg-H2O2��ؿ������������˼�ʻ��DZ�������õ���Ժ�ˮΪ�������Һ��ʾ��ͼ���¡��õ�ع���ʱ������˵����ȷ���ǣ� ��

A. Mg �缫�Ǹõ�ص�����
B. H2O2��ʯī�缫�Ϸ���������Ӧ
C. ʯī�缫������Һ��pH ����
D. ��Һ��Cl���������ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijʵ��С����̽��SO2��Cl2�ܷ�����Ӧ�������ͼ��ʾ��ʵ��װ�ý���ʵ�顣
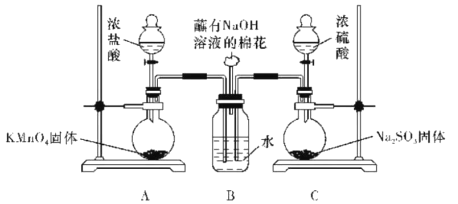
��1��װ��A��ȡ�������÷�Ӧ�Ļ�ѧ����ʽ��__��
��2��Ϊ��֤SO2��Cl2�����˷�Ӧ��С��ͬѧ�ּ�������ʵ�顣
�ټ�ͬѧ��Ϊ��SO2��Cl2��Ӧ��������Cl-��ֻҪ���鵽���ɵ�Cl-���ɣ���ȡ����B����Ʒ���Թ��У������еμ�����__��Һ���а�ɫ�������ɡ�
����ͬѧ��Ϊ��ͬѧ�Ľ��۲���������ΪӦ����װ��A��B������һ��ϴ��ƿ��Ȼ���ٰ���ͬѧ�ķ���ʵ�鼴�ɵõ���ȷ���ۡ�ϴ��ƿ��ʢ���Լ���������___��
�۱�ͬѧ��Ϊ����ͬѧ�Ľ���Ľ�ʵ��Ҳ��������������__��
�ܱ�ͬѧȡ��ҺX���Թ��У�����������Ӧ��B�е���Һ�����ɴ�����ɫ�������ó���ȷ���ۣ�SO2��Cl2ͬʱͨ��ˮ�У����Է�����Ӧ����ҺX��__��������ĸ���ţ�
a.BaCl2��Һ b.Ba(OH)2��Һ c.��ˮ d.ʯ����Һ
SO2��Cl2ͬʱͨ��ˮ�з�Ӧ�Ļ�ѧ����ʽ��__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A.����ʯ��ˮ�м������С�մ���Һ��![]() ��Ca2����OH����CaCO3����H2O
��Ca2����OH����CaCO3����H2O
B.��������Һ��ͨ������CO2��2C6H5O����CO2��H2O ===2C6H5OH����![]()
C.��ʪ�����и��������绯ѧ��ʴ�ķ�Ӧ��Fe��2H2O��Fe(OH)2��H2��
D.������Һ��KIO3��KI��Ӧ����I2��![]() ��5I����6H��=3I2��3H2O
��5I����6H��=3I2��3H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��300��ʱ��������X������Y��0.16mol����10L�����ܱ������У�������Ӧ��X(g)+Y(g)2Z(g)��H��0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
(1)��Ӧ0~2minZ��ƽ������v(Z)=____
(2)���жϸ÷�Ӧ�Ѿ��ﵽƽ��״̬����____
A������X������������Z�����ʵ�2�� B��������ѹǿ���ֲ���
C��������������ܶȱ��ֲ��� D�������ڸ������Ũ�ȱ��ֲ���
(3)�¶�Ϊ300��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��K�� ___
II��(1)�����£�0.005mol��L-1Ba(OH)2��Һ��pH��_____
(2)�����£���0.1mol��L-1NH3��H2O��Һ�в��ϼ�ˮ��������c(OH-)/c(NH3��H2O)��____(ѡ����������������С��������������
(3)�±��г��˼������������������������pH����ʼ������pH����������Ũ��Ϊ1.0mol��L-1���㣩
Fe3�� | Al3�� | Zn2�� | |
��ʼ������pH | 1.1 | 3.2 | 5.9 |
��ȫ������pH | 3.2 | 5 | 8.9 |
ij��Һ�к�Fe3����Al3����Zn2��������ȥFe3����Al3���������еμ�1.0moL��L-1��NaOH��Һ������Һ��pHΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ľṹ��ʽΪ![]() �������ܾ��е�������
�������ܾ��е�������
A. ����ʹ��ˮ��ɫ��������ʹ���Ը��������Һ��ɫ
B. ������ʹ��ˮ��ɫ��Ҳ��ʹ���Ը��������Һ��ɫ
C. ������ˮ��Ҳ�������л��ܼ�
D. �ܷ����ӳɷ�Ӧ��һ���������������������ʵ����������ӳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯����㷺Ӧ���ڽ���ұ�����л��ϳɵ�����
�����ȷ�Ӧ����ұ����������Cr��̬��������Ų�ʽΪ_______��
����֪��Ӧ��

��������������̼ԭ�ӹ�����ӻ�����Ϊ______��
��1 mol�Լ�����ͪ�����к��е���������ĿΪ_____��
�ۼױ�����������ˮ��ԭ����______��
�ܵ���AlCl3��̬���ӵĿռ乹��Ϊ______��AlCl3����Cl���γ�AlCl![]() ����AlCl
����AlCl![]() ��Ϊ�ȵ�����ķ���Ϊ______��
��Ϊ�ȵ�����ķ���Ϊ______��
(3)ij�ڹ���ľ�������ͼ��ʾ����n��______��
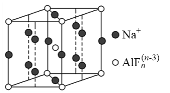
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com