
【题目】温度为T 时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,
反应:PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡,反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 250 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是
A. 反应在前50 s内的平均速率v(PCl3)=0.0032mol/(L·s)
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol/L,该反应为放热反应
C. 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,达到平衡前的v正>v逆
D. 相同温度下,起始时向容器中充入2.0 mol PCl3、2.0 mol Cl2,达到平衡时,PCl3的转化率小于80%
【答案】C
【解析】
A、反应在前50 s内PCl3的物质的量增加0.16mol,所以前50 s内的平均速率v(PCl3)=![]() =0.0016mol/(L·s),故A错误;
=0.0016mol/(L·s),故A错误;
B、原平衡时PCl3的物质的量浓度c(PCl3)= 0.20mol÷2.0L=0.10mol/L,若升高温度,平衡时c(PCl3)=0.11mol/L,PCl3的浓度比原平衡时增大了,说明升高温度,平衡正向移动,则正向是吸热反应,故B错误;
C、根据表中数据可知平衡时Cl2的浓度是0.1mol/L,PCl5的浓度是0.4mol/L,则该温度下的平衡常数K=![]() =0.025,相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mo1 Cl2,Qc=
=0.025,相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mo1 Cl2,Qc=![]() =0.02<0.025,所以反应正向进行,达平衡前v正>v逆,故C正确;
=0.02<0.025,所以反应正向进行,达平衡前v正>v逆,故C正确;
D、相同温度下,起始时向容器中充入1.0 mol PCl3、1.0 mol Cl2,则与原平衡是等效平衡,原平衡中五氯化磷的转化率是0.2mol÷1.0mol×100%=20%,所以三氯化磷的转化率是80%,而向容器中充入2.0 mol PCl3、2.0 mol Cl2,相当于容器的体积缩小一倍,压强增大,则平衡逆向移动,所以三氯化磷的转化率大于80%,故D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】研究NO2、NO、SO2、CO等大气污染气体的处理具有重要意义。利用反应6NO2(g)+8NH3(g)![]() 7N2(g)+12H2O(g)可处理NO2。
7N2(g)+12H2O(g)可处理NO2。
(1)在2L的密闭容器中,2分钟内,上述反应混合物的物质的量增加了0.25mol,则2分钟内v(NH3)=______。
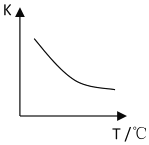
(2)该反应的化学平衡常数表达式K=______;已知该反应平衡常数(K)与温度(T)的关系如图所示,若升高温度,则v正反应______v逆反应(填“大于”、“小于”或“等于”);反应达到平衡后若缩小反应容器体积,其它条件不变,则混合气体的平均式量将______(填“变大”、“变小”或“不变”)。
酸雨是大气污染的危害之一,二氧化硫(SO2)的含量是空气质量监测的一个重要指标。某兴趣小组同学收集某地的雨水进行实验,每隔1h,通过pH计测定雨水样品的pH,测得的结果如下表:
测定时间/h | 0 | 1 | 2 | 3 | 4 |
雨水样品的pH | 4.73 | 4.62 | 4.56 | 4.55 | 4.55 |
(3)请写出上述pH变化的原因______。
(4)有物质的量浓度相等的三种铵盐溶液:①NH4Cl ②NH4HCO3 ③NH4HSO4,这三种溶液中水的电离程度由大到小的顺序是______(填编号)。
(5)向BaCl2溶液中通入足量SO2气体,没有沉淀生成,继续滴加一定量的氨水后,生成BaSO3沉淀,用电离平衡原理解释上述现象。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1mol H-O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A.920 kJB.557 kJC.436 kJD.188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物吗替麦考酚酯有强大的抑制淋巴细胞增殖的作用,可通过如下反应制得:

下列叙述正确的是
A. 用溴水可鉴别化合物X和Z B. 化合物Y的分子式为C6H13NO2
C. 化合物Z中含有手性碳原子 D. 1mol化合物Z可以与3mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为了探究锌与盐酸反应过程中的速率变化,他在100mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折算为标准状况下的体积),实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
(1)反应速率最大的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(2)反应速率最小的时间段是__(填“0~1min”“1~2min”“2~3min”或“4~5min”),原因是__。
(3)2~3min时间段内,以盐酸的浓度变化表示该反应的速率为__。
(4)如果反应太剧烈,为了减缓反应速率而又不减少产生氢气的量,该同学在盐酸中分别加入等体积的下列液体,你认为可行的是__(填序号)。
A.蒸馏水 B.NaCl溶液 C.Na2CO3溶液 D.CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)2C(g)+2D(g),反应进行到10 s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol。
(1)用C表示10s内反应的平均反应速率为_____________。
(2)反应前A的物质的量浓度是_________。
(3)10 s末,生成物D的浓度为________。
(4)平衡后,若改变下列条件,生成D的速率如何变化(填“增大”、“减小”或“不变”):
①降低温度____;②增大A的浓度_____;③恒容下充入氖气________。
(5)下列叙述能说明该反应已达到化学平衡状态的是(填标号)_________。
A.v(B)=2v(C)
B.容器内压强不再发生变化
C.A的体积分数不再发生变化
D.器内气体密度不再发生变化
E.相同时间内消耗n mol的B的同时生成2n mol的D
(6)将固体NH4I置于密闭容器中,在某温度下发生下列反应:NH4I(s)NH3(g)+HI(g),2HI(g)H2(g)+I2(g)。当反应达到平衡时,c(H2)=0.5mol·L1,c(HI)=4mol·L1,则NH3的浓度为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅酸蓄电池价格低廉,原材料易得,适用范围广。其放电时的反应原理为:
Pb+PbO2+2H2SO4===2PbSO4+2H2O。

(1) 写出铅酸蓄电池放电时正极的电极反应式:________,放电时,H+向电池______极定向移动(填“正”或“负”)。
(2) 传统的铅酸蓄电池在充电末期,电极上会产生O2,为了避免气体逸出形成酸雾腐蚀设备,科学家发明了密封铅蓄电池(VRLA),采用阴极吸收法达到密封效果。其原理如图所示,则O2在阴极被吸收的电极反应式为________。
(3) 铅的电解精炼是工业上实现废铅回收以及粗铅提纯的重要手段。铅的电解精炼在由PbSiF6和H2SiF6两种强电解质组成的水溶液中进行。从还原炉中产出的某粗铅成分如下表所示:
成分 | Pb | Cu | Ag | Fe | Zn | Sn | 其它 |
% | 97.50 | 1.22 | 0.12 | 0.15 | 0.09 | 0.64 | 0.28 |
①电解精炼时阳极泥的主要成分是________(元素符号)。
②电解后阴极得到的铅中仍含有微量的杂质,该杂质最有可能是________(填一种)。
③电解过程中,粗铅表面会生成SiF6气体,写出该电极反应式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO2和H2可直接合成甲醇,向一密闭容器中充入CO2和H2,发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH= a kJ/mol
CH3OH(g)+H2O(g) ΔH= a kJ/mol
①保持温度、体积一定,能说明上述反应达到平衡状态的是________。
A.容器内压强不变 B.3v正(CH3OH)= v正(H2)
C.容器内气体的密度不变 D.CO2与H2O的物质的量之比保持不变
②测得不同温度时CH3OH的物质的量随时间的变化如图所示,则a______0(填“>”或“<”)。

(2)工业生产中需对空气中的CO进行监测。
①氯化钯(PdCl2)溶液可以检验空气中少量的CO。当空气中含CO时,溶液中会产生黑色的Pd沉淀。若反应中有0.02 mol电子转移,则生成Pd沉淀的质量为________。
②使用电化学一氧化碳气体传感器定量检测空气中CO含量,其模型如图所示。这种传感器利用了原电池原理,则该电池的负极反应式为________。

(3)某催化剂可将CO2和CH4转化成乙酸。催化剂的催化效率和乙酸的生成速率随温度的变化关系如图所示。乙酸的生成速率主要取决于温度影响的范围是________。

(4)常温下,将一定量的CO2通入石灰乳中充分反应,达平衡后,溶液的pH为11,则c(CO32-)=_______。(已知:Ksp[Ca(OH)2]=5.6×106,Ksp(CaCO3) =2.8×109)
(5)将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。图4是通过光电转化原理以廉价原料制备新产品的示意图。催化剂a、b之间连接导线上电子流动方向是_______(填“a→b”或“b→a”)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现向一密闭容器中充入1 molN2和3 molH2,在一定条件下发生反应:N2+3H2![]() 2NH3,下列有关说法正确的是
2NH3,下列有关说法正确的是
A. 达到化学平衡时,N2将完全转化为氨
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com