
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料的优点是_________(至少答出两点)。但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:____________。
(2)以甲烷为原料可制得氢气。图1是一定温度、压强下,CH4(g)与H2O(g)反应生成CO(g)和1mol H2(g)的能量(KJ)变化示意图,写出该反应的热化学方程式_______________(△H用E1、E2、E3表示)。

(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
A.容器内气体压强保持不变
B.吸收y mol H2只需1 mol MHx
C.若降温,该反应的平衡常数增大
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(4)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-![]() FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42-+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42-,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①电解一段时间后,c(OH-)降低的区域在__________(填“阴极室”或“阳极室”)。
②电解过程中,须将阴极产生的气体及时排出,其原因是_____________。
③c(Na2FeO4)随初始c(NaOH)的变化如图2,分析N点c( Na2FeO4)低于最高值的原因:_____________。
(5)在容积可变的密闭容器中充入10molCO和20molH2,发生CO ( g ) + 2H2 ( g )![]() CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。
CH3OH ( g ) △H<0, CO 的平衡转化率随温度(T)、压强(P)的变化如图所示,当达到平衡状态A 时,容器的体积为1 L。若反应开始时仍充入10mol CO 和20mol H2,则在平衡状态B时容器的体积V(B)= L。

【答案】(1)污染小;可再生;来源广;资源丰富;燃烧热值高(任写其中2个)(2分);
H2+2OH-+2e-=2H2O(2分)(2)CH4(g)+H2O(g)═CO(g)+3H2(g) △H=3(E2-E1)kJ·mol-1
(3)ac(2分) (4)①阳极室(1分) ②防止Na2FeO4与H2反应使产率降低 (1分)
③N点:c(OH)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。(2分) (5)0.2L(2分)
【解析】
试题分析:(1)与汽油相比,氢气作为燃料的优点有污染小;可再生;来源广;资源丰富;燃烧热值高等,碱性氢氧燃料电池的负极反应式为H2+2OH--2e-=2H2O;
(2)根据图像可知生成物总能量高于反应物总能量,反应是吸热反应,则热化学方程式为 CH4(g)+H2O(g)═CO(g)+3H2(g) △H=3(E2-E1)kJ·mol-1。
(3)MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。A.平衡时气体的物质的量不变,压强不变,正确;B.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;C.降低温度,平衡向正反应方向移动,平衡常数增大,正确;D.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;答案选ac;
MHx+2y(s) ΔH<0,该反应属于气体的物质的量发生变化的反应。A.平衡时气体的物质的量不变,压强不变,正确;B.该反应为可逆反应,吸收y mol H2需要大于1 mol 的MHx,错误;C.降低温度,平衡向正反应方向移动,平衡常数增大,正确;D.向容器内通入少量氢气,相当于增大压强,平衡正向移动,v(放氢)<v(吸氢),错误;答案选ac;
(4)①根据题意镍电极有气泡产生是氢离子放电生成氢气,铁电极发生氧化反应,溶液中的氢氧根离子减少,因此电解一段时间后,c(OH)降低的区域在阳极室;
②氢气具有还原性,根据题意Na2FeO4只在强碱性条件下稳定,易被H2还原。电解过程中,须将阴极产生的气体及时排出,防止Na2FeO4与H2反应使产率降低;
③根据题意Na2FeO4只在强碱性条件下稳定,在M点,c(OH-)低,Na2FeO4稳定性差,且反应慢,在N点:c(OH-)过高,铁电极上有氢氧化铁生成,使Na2FeO4产率降低。
(5)当达到平衡状态A 时,CO转化率是0.5,则消耗CO是5mol,氢气是10mol,生成甲醇是5mol,剩余CO和氢气分别是5mol、10mol,则该温度下平衡常数K=![]() ;平衡状态B时CO中的转化率是0.8,则消耗CO是8mol,氢气是16mol,生成甲醇是8mol,剩余CO和氢气分别是2mol、4mol,则
;平衡状态B时CO中的转化率是0.8,则消耗CO是8mol,氢气是16mol,生成甲醇是8mol,剩余CO和氢气分别是2mol、4mol,则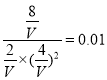 ,解得V=0.2L,即在平衡状态B时容器的体积V(B)=0.2L。
,解得V=0.2L,即在平衡状态B时容器的体积V(B)=0.2L。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】科学家目前正在求证一种仅由四个中子组成的微粒,这种微粒称为“四中子”,下列关于该微粒的说法正确的是( )
A. 呈电中性 B. 带四个单位负电荷
C. 带四个单位正电荷 D. 质量数为2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常见金属A存在如下的转化关系(图中有些反应的产物和条件没有全部标出),其中E为白色沉淀。
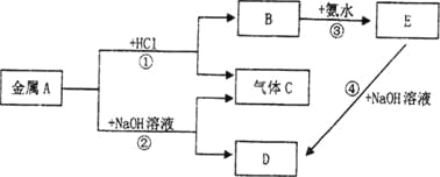
请回答下列问题:
(1) A的化学式为______________。
(2) C的电子式为_________________。
(3) 反应③的化学方程式为_________________________。
(4) 反应④的离子方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关,下列有关说法不正确的是:
A. 人造纤维和合成橡胶都属于有机高分子化合物
B. 荧光蛋白是一种高分子化合物且能发生水解
C. Na2FeO4能与水缓慢反应生成Fe(OH)3和O2,可以作为饮用水的消毒剂和净化剂
D. 利用次氯酸钠溶液的碱性对餐具和环境消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质间的转化,能经过一步化合反应直接转化的是( )
A.SiO2→H2SiO3
B.Na2O2→Na2CO3
C.Fe→Fe(OH)3
D.Al2O3→Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:
A(g)+2B(g)![]() 3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
3C(g)+nD(g),开始时A为4mol,B为6mol;5min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol/(L·min)。计算
(1)5min末A的物质的量浓度为__________ mol/L·
(2)前5min内用B表示的化学反应速率v(B)为___________ mol/(L·min)。
(3)化学方程式中n值为__________。
(4)此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol/(L·min)
②v(B)=6mol/(L·min)
③v(C)=4.5mol/(L·min)
④v(D)=8mol/(L·min)
其中反应速率最快的是__________(填编号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因存在浓度差而产生电动势的电池称为浓差电池。利用如图所示装置进行实验,开始先闭合K2,断开Kl,一段时间后,再断开K2,闭合Kl,形成浓差电池,电流计指针偏转(Ag+浓度越大,氧化性越强)。下列说法不正确的是

A. 闭合K2,断开Kl一段时间后,X电极质量增加
B. 闭合K2,断开Kl一段时间后,右池c(AgNO3)增大
C. 断开K2,闭合K1, X 电极发生氧化反应
D. 断开K2,闭合K1, NO3-从左池向右池移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学对教材中铜与浓硫酸的实验作了如下改进。实验装置如图所示(加热和夹持装置己略去)。

实验步骤:
①组装仪器,检查装置气密性;
②加入试剂,关闭旋塞E,加热A,观察C中溶液颜色变化;
③将铜丝上提离开液面,停止加热。
(1)检査虚线框内装置气密性的方法是____________________。
(2)仪器A的名称是_________________,仪器B的作用是_________________,仪器D中所盛药品是_________________。
(3)装置A中发生反应的化学方程式为_________________。
(4)实验后,拆除装置前,为避免有害气体的泄漏,应当采取的操作是_______________。
(5)实验后仪器A中有白色固体产生,将仪器A中固液混合物缓慢转移至盛有少量水的烧杯中,可观察到的现象是_____________,用所得溶液做焰色反应实验时,观察到的火焰颜色为___________。不可直接向仪器A中加水的原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com