
| A、H2SO4、HNO3 |
| B、HCl、HNO3 |
| C、HCl、H2SiO3、 |
| D、HCl、H2SO4 |
科目:高中化学 来源: 题型:
 有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶 液,得到的沉淀量与加入的NaOH溶液体积的关系如图所示,则原溶液中Cl-与SO42-物质的量浓度之比为( )
有MgSO4、AlCl3的混合溶液,向其中不断加入NaOH溶 液,得到的沉淀量与加入的NaOH溶液体积的关系如图所示,则原溶液中Cl-与SO42-物质的量浓度之比为( )| A、3:2 | B、2:3 |
| C、1:2 | D、2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中:MnO4-、Na+、SO42-、HCO3- |
| B、氯水中:CO32-、NO3-、SO42-、Na+ |
| C、常温常压下:NH3、O2、H2、CO2 |
| D、使酚酞变红的溶液中:K+、Cu2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、100℃时,0.1 mol?L-1 HCl和NaOH溶液的pH分别为1和13 |
| B、将pH=4的醋酸溶液加水稀释后,溶液中所有离子的浓度均降低 |
| C、等体积、等pH的HCl和CH3COOH溶液分别与NaOH溶液反应,CH3 COOH消耗NaOH的物质的量多 |
| D、在滴有酚酞溶液的氨水中,加入NH4Cl至溶液无色,此时溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④⑤⑥⑦ |
| B、②③⑤⑦ |
| C、③⑤⑥⑦ |
| D、①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应混合气体的颜色不再变化 |
| B、CO、CO2两种物质浓度一定相等 |
| C、CO和NO2 全部变成CO2和N2 |
| D、升高温度,正反应速率增大,逆反应速率则减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 |
| B、硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 |
| C、电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
| D、工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
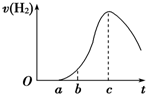 把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
把在空气中久置的铝片5.0g投入盛有500mL 0.5mol?L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4 4 g CO2气体中所含原子数为2 NA |
| B、常温常压下,22.4 L氢气所含原子数为2 NA |
| C、1 L mo l?L-1的硫酸钠溶液中钠离子数为2 NA |
| D、在Cl2参与的反应中,1 mol Cl2得到的电子数一定是2NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com