
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
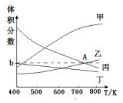
分析 (1)根据图求出0~1min,υ(H2)=$\frac{\frac{8-6}{20}}{1}$=0.1mol•(L•min)-1,然后根据速率之比等于对应物质的化学计量数之比,平衡常数等于平衡时生成物浓度幂之积比反应物浓度幂之积,由此分析解答;
(2)反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高;平衡时CH3CH2OH(g)、H2O(g)的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;由①方向可知,图中曲线乙和丙的交点A表示平衡时CO2、H2O的含量相等,令H2与CO2的起始物质的量分别为3mol、1mol,设平衡时乙醇的物质的量为xmol,利用三段式表示出平衡时各组分的物质的量,再根据CO2、H2O的含量相对列方程计算解答;
(3)A.正反应是放热反应,升高温度平衡逆向移动;
B.将CH3CH2OH(g)及时液化抽出,减少生成物的浓度平衡正向移动;
C.选择高效催化剂,平衡不移动;
D.再充入l molCO2和3molH2,相当于增大压强,平衡正向移动;
(4)9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,则1mol 液态乙醇完全燃烧,当恢复到原状态时,放出1367kJ的热量,据此书写;
(5)正极氧气发生还原反应,电极反应式为:O2+2H2O+4e-═4OH?.
解答 解:(1)根据图求出0~1min,υ(H2)=$\frac{\frac{8-6}{20}}{1}$=0.1mol•(L•min)-1,所以υ(CH3CH2OH)=$\frac{1}{6}×0.1$=0.0167mol/(L•min),
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
c(初起):$\frac{4}{30}$ 0.4 0 0
c(变化):0.05 0.15 0.025 0.075
c(平衡):0.08 0.25 0.025 0.075
K=$\frac{0.07{5}^{3}×0.025}{0.0{8}^{2}×0.2{5}^{6}}$=6.22,
故答案为:0.0167mol/(L•min);6.22;
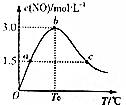
(2)反应为放热反应,升高温度平衡向逆反应移动,平衡时CO2与H2的含量增大,开始n(H2)/n(CO2)=3,H2与CO2反应按3:1进行,平衡时H2的含量是CO2的含量三倍,平衡时H2的含量比二氧化碳高,平衡时CH3CH2OH(g)、H2O(g)的含量降低,CH3CH2OH与H2O按1:3反应,平衡时H2O的含量是CH3CH2OH含量的三倍,平衡时H2O的含量高;曲线甲、曲线乙随温度升高含量增大,且曲线Ⅰ的含量高,所以曲线甲表示H2、曲线乙表示CO2,曲线丙、曲线丁随温度升高含量减小,且曲线丙的含量高,所以曲线丙表示H2O、曲线丁表示CH3CH2OH,2CO2(g)+6H2(g)=CH3CH2OH(g)+3H2O(g);
由①方向可知,图中曲线Ⅱ和Ⅲ的交点a表示平衡时CO2、H2O的含量相等,令H2与CO2的起始物质的量分别为3mol、1mol,设平衡时乙醇的物质的量为xmol,则:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
开始(mol):1 3 0 0
变化(mol):2x 6x x 3x
平衡(mol):1-2x 3-6x x 3x
故1-2x=3x,解得x=0.2
故图中曲线乙和丙的交点A对应的体积分数b=$\frac{3x}{1-2x+3-6x+x+3x}$×100%=$\frac{3x}{4-4x}$×100%=$\frac{3×0.2}{4-4×0.2}$×100%=18.8%,
故答案为:CO2;18.8;
(3)A.正反应是放热反应,升高温度平衡逆向移动,故不符合;
B.将CH3CH2OH(g)及时液化抽出,减少生成物的浓度平衡正向移动,故符合;
C.选择高效催化剂,平衡不移动,故不符合;
D.再充入l molCO2和3molH2,相当于增大压强,平衡正向移动,故符合;
故选:BD;
(4)9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,则1mol 液态乙醇完全燃烧,当恢复到原状态时,放出1367kJ的热量,所以热化学方程式为:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1,
故答案为:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1;
(5)正极氧气发生还原反应,电极反应式为:O2+2H2O+4e-═4OH?,故答案为:O2+2H2O+4e-═4OH?.
点评 本题目综合考查化学反应速率和化学平衡移动的影响因素以及有关化学平衡的转化率、平衡常数的计算等方面的知识,题目难度中等,注意明确影响化学反应速率、化学平衡的因素,掌握化学平衡常数的概念及计算方法.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:解答题
| 离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
| c(mol•L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
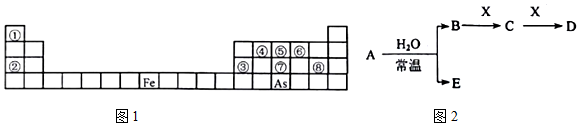
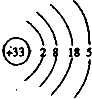 ;其氢化物的化学式为AsH3.
;其氢化物的化学式为AsH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纳米铁粉可以高效地去除被污染水体中的 Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 | |
| B. | 凡含有添加剂的食物对人体健康均有害,不宜食用 | |
| C. | 煤经过气化和液化等物理变化可以转化为清洁燃料 | |
| D. | 火力发电中,燃烧是使化学能转换为电能的关键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
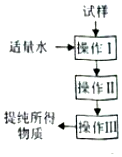 实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )
实验室按照如图操作程序提纯某种物质,下列分析一定正确的是( )| A. | 操作I一定是过滤,其目的是将固液分离 | |
| B. | 可以提纯含少量氧化铁杂质的氧化铝 | |
| C. | 可以提纯含少量氯化钠杂质的硝酸钾 | |
| D. | 可以提纯含少量碘杂质的氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
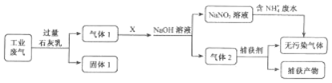
 合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.
合成氨工业是我省开磷集团的重要支柱产业之一.氨是一种重要的化工原料,在工农业生产中有广泛的应用.| 化学键 | N-H | N≡N | Br-Br | H-Br |
| 键能/kJ•mol-1 | 391 | 946 | 194 | 366 |
| 时间/min | CH4(mol) | H2O(mol) | CO (mol) | H2 (mol) |
| 0 | 0.40 | 1.00 | 0 | 0 |
| 5 | a | 0.80 | c | 0.60 |
| 7 | 0.20 | b | 0.20 | d |
| 10 | 0.21 | 0.81 | 0.19 | 0.64 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{mω}{28V}$mol•L-1 | B. | $\frac{mω}{56V}$ mol•L-1 | C. | $\frac{mω}{112V}$mol•L-1 | D. | $\frac{mω}{V}$ mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com