
| ʵ�鲽�衢Ԥ������ | ���� |
| ������Һ�м������Ȼ�̼�����������ã� ����CCl4��ʳȺ�ɫ��ˮ�����ɫ | ����1��ȷ |
| ������Һ������KSCN��Һ�� ������Һ��Ϊ��ɫ | ����2��ȷ |
���� ��1����������һ�����ʵ���Ũ����Һ��һ�㲽��ѡ����Ҫ������
��2��a����m=CVM������Ҫ���ʵ�������
b����ƿΪ�����������������ܽ���壻
cΪ����������ȫ��ת�Ƶ�����ƿ��Ӧ����ϴ�Ӳ�����
d����ƿ���ܹ���������ʢ����Һ��
e����ʱ����������ƿ�̶��ߵ�����Һ���ƫ������c=$\frac{n}{V}$�ж���
��3������1��Br-��C12������Br2�ܽ�����Һ�У�ͨ����Һ�м����������Ȼ�̼����ȡ���嵥�ʴӶ�ʹCCl4��ʳȺ�ɫ��֤�����嵥�����ɣ�����2��Fe2+��C12������Fe3+�������Һ�м���KSCN��Һ����Һ��Ϊ��ɫ֤�������������ɣ�
�����������Ȼ�̼�����Ȼ�̼�ܶȴ���ˮ����ˮ�������ܣ��ݴ�ѡ����뷽����
��4��50mL����FeBr2��Һ�����廯�������ʵ���n=0.1mol/L��0.05L=0.005mol��
��״����112mL Cl2���ʵ���n=$\frac{0.112L}{22.4L/mol}$=0.005mol��
��ԭ��Fe2+��Br-��������1��1��Ӧ���ɵ����غ��֪����������ȫ����������������һ�뱻������
��� �⣺��1������һ�����ʵ���Ũ����Һ��һ�㲽�裺���㡢�������ܽ⡢��Һ��ϴ�ӡ����ݣ��õ���������������ƽ��ҩ�ס��ձ���������������ƿ����ͷ�ιܣ�����90mL 0.10mol•L-1FeBr2��Һ��Ӧѡ��100mL����ƿ�����Ի�ȱ�ٵ���������������100mL����ƿ��
�ʴ�Ϊ����������100mL����ƿ��
��2��a��Ҫ90mL 0.10mol•L-1FeBr2��Һ����Ҫ���ʵ�����=0.1mol/L��0.1L��216g/mol=2.16g����a����
b����ƿΪ�����������������ܽ���壬Ӧ�����ձ���Ӧ����30mL����ˮ�ܽ⣬��b����
cΪ����������ȫ��ת�Ƶ�����ƿ��Ӧ����ϴ�Ӳ���������ϴ��Һת��������ƿ�У���c��ȷ��
d����ƿ���ܹ���������ʢ����Һ��Ӧת�Ƶ��Լ�ƿ��ʢ�ţ���d����
e����ʱ����������ƿ�̶��ߵ�����Һ���ƫ������c=$\frac{n}{V}$��֪��ҺŨ��ƫ�ͣ���e����
��ѡ��abde��
��3������1��Br-��C12������Br2�ܽ�����Һ�У�ͨ����Һ�м����������Ȼ�̼����ȡ���嵥�ʴӶ�ʹCCl4��ʳȺ�ɫ��֤�����嵥�����ɣ�����2��Fe2+��C12������Fe3+�������Һ�м���KSCN��Һ����Һ��Ϊ��ɫ֤�������������ɣ�
�����������Ȼ�̼�����Ȼ�̼�ܶȴ���ˮ����ˮ�������ܣ���Һ�ֲ㣬����ѡ����ȡ��Һ�����룻
�ʴ�Ϊ��
| �������ã� CCl4��ʳȺ�ɫ��ˮ�����ɫ | |
| ��KSCN��Һ�� ��Һ��Ϊ��ɫ |
���� ����Ϊ�ۺ��⣬������һ�����ʵ���Ũ����Һ�����Ƽ�������ԭ��Ӧ�����Ի�ԭ��ǿ���жϣ���ȷ����ԭ�����������裬��Ϥ���ʵ����ʼ�������ԭ��Ӧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 �����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д�
�����ѧСѧ�꼶�νӵ������㽭��ѧ������ϵ�д� Сѧ�����ҵ���ϴ�ѧ������ϵ�д�
Сѧ�����ҵ���ϴ�ѧ������ϵ�д� ���Ž�����ٰθ��νӹ㶫���������ϵ�д�
���Ž�����ٰθ��νӹ㶫���������ϵ�д� �����������ҵ�������������ϵ�д�
�����������ҵ�������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v����������v���棩��С | B�� | v��������С��v���棩���� | ||
| C�� | v��������v���棩��ͬ�̶����� | D�� | v��������v���棩ͬ�ȳ̶����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
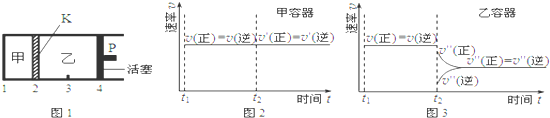
| A�� | ���ֻ���λ�ò��䣬�����¶ȣ��ﵽ�µ�ƽ��ס�����B��������������� | |
| B�� | �����¶Ⱥͻ���λ�ò��䣬�ڼ����ټ���1 mol A��2 mol B���ﵽ�µ�ƽ�����C��Ũ��������C��Ũ�ȵ�2�� | |
| C�� | �����¶Ⱥ����е�ѹǿ���䣬t2ʱ�ֱ���ס����м���������ĺ����ס����з�Ӧ���ʱ仯����ֱ���ͼ2��ͼ3��ʾ��t1ǰ�ķ�Ӧ���ʱ仯��ʡ�ԣ� | |
| D�� | �����¶Ȳ��䣬�ƶ�����P��ʹ�ҵ��ݻ��ͼ���ȣ��ﵽ�µ�ƽ�������C����������Ǽ���C�����������2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

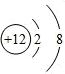 ��A�ĵ���ʽΪ
��A�ĵ���ʽΪ ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
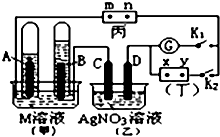 ��ͼ��ʾ��ʵ��װ�ã���Ϊ�õ��۵⻯�غͷ�̪�����Һ��ʪ����ֽ��m��nΪ������ֽ���˵IJ��У���Ϊֱ����Դ��x��yΪ��Դ��������GΪ�����ƣ��缫��Ϊʯī�缫���պ�K2���Ͽ�K1��һ��ʱ���A��B�����������������֮��Ϊ2��1���ش��������⣺
��ͼ��ʾ��ʵ��װ�ã���Ϊ�õ��۵⻯�غͷ�̪�����Һ��ʪ����ֽ��m��nΪ������ֽ���˵IJ��У���Ϊֱ����Դ��x��yΪ��Դ��������GΪ�����ƣ��缫��Ϊʯī�缫���պ�K2���Ͽ�K1��һ��ʱ���A��B�����������������֮��Ϊ2��1���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
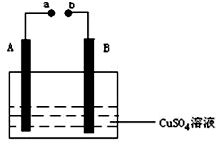 ��ͼ��ʾװ��Ϊ��ֱ����������µ��CuSO4��Һͼ������A��BΪʯī�缫��a��bΪ��Դ������������ͨ��Դ��ͨ��һ��ʱ���B�缫ȡ��ϴ�ɾ�����������������������3.2g����
��ͼ��ʾװ��Ϊ��ֱ����������µ��CuSO4��Һͼ������A��BΪʯī�缫��a��bΪ��Դ������������ͨ��Դ��ͨ��һ��ʱ���B�缫ȡ��ϴ�ɾ�����������������������3.2g�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO��g�� ��Na2O2��s����Ӧ�ų�509kJ����ʱ������ת����Ϊ6.02��1023 | |
| B�� | 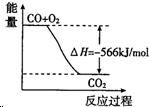 ͼ�ɱ�ʾ��CO����CO2�ķ�Ӧ���̺�������ϵ | |
| C�� | 2Na2O2��s��+2CO2��s���T2Na2CO3��s��+O2��g����H��-452kJ/mol | |
| D�� | CO��ȼ����Ϊ283kJ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com