
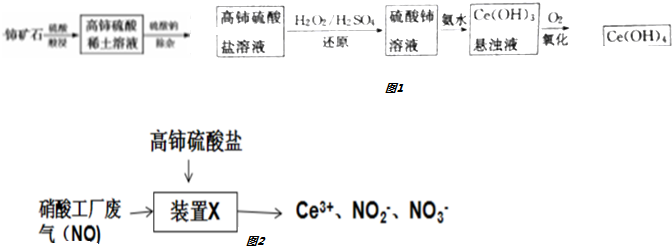
分析 铈矿石加入硫酸酸浸得到高铈硫酸盐,加入过氧化物稀硫酸还原高铈硫酸盐得到硫酸铈溶液,加入氨水生成Ce(OH)3沉淀,通入氧气氧化得到Ce(OH)4,高铈硫酸盐溶液可用于吸收硝酸工厂废气中的NO,Ce4+具有氧化性,NO具有还原性,Ce4+本身被还原为Ce3+,NO被氧化为NO2-、NO3-.
(1)NO中+2价的氮具有还原性,高铈硫酸盐中+4价的铈具有氧化性,两者发生氧化还原反应,根据流程图可知,铈被还原成+3价,氮被氧化成+3、+5价,据此分析解答;
(2)硫酸根离子为-2价,硫酸铈钠中,钠离子为+1价,铈离子为+3价,硫酸铈钠中各离子的物质的量之比为1:1:2,根据化合物中各元素的化合价等于零分析解答;
(3)过氧化氢还原高铈硫酸盐得到硫酸铈溶液,过氧化氢不稳定,易分解;
(4)加入氨水生成Ce(OH)3沉淀;
(5)NaClO中+1价的氯具有强氧化性,Ce(OH)3中+3价的铈被+1的氯氧化,根据得失电子守恒、原子守恒书写方程式;
(6)Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒n[Ce(OH)4]=n[(NH4)2Fe(SO4)2],进而计算产品纯度.
解答 解:(1)高铈是指溶液中Ce为+4价,+4价的铈具有氧化性,高铈硫酸盐溶液可用于吸收硝酸工厂废气中的NO,NO中+2价的氮具有还原性,两者发生氧化还原反应,根据流程图可知,铈被还原成+3价,氮被氧化成+3、+5价,氧化产物为NO2-、NO3-,
故答案为:NO2-、NO3-;
(2)离子化合物中,钠离子为+1价,硫酸根离子为-2价,高铈是指溶液中Ce为+4价,硫酸铈钠中,铈离子为+3价,硫酸铈钠中各离子的物质的量之比为1:1:2,根据化合物中各元素的化合价等于零可知:n(Na+):n(Ce3+):n(SO42-)=1:1:2,则硫酸铈钠的化学式为:NaCe(SO4)2,
故答案为:NaCe(SO4)2;
(3)过氧化氢还原高铈硫酸盐得到硫酸铈溶液,“还原”过程温度过高,过氧化氢会分解放出氧气,
故答案为:防止H2O2分解;
(4)高铈硫酸盐加入过氧化氢、稀硫酸还原高铈硫酸盐得到硫酸铈溶液,加入氨水,发生反应:Ce3++3NH3•H2O=Ce(OH)3↓+3NH4+,生成Ce(OH)3沉淀,
故答案为:Ce3++3NH3•H2O=Ce(OH)3↓+3NH4+;
(5)NaClO与Ce(OH)3反应生成Ce(OH)4,Ce元素由+3价变为+4价,被氧化,NaClO应被还原生成NaCl,然后配平得出反应的化学方程式为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl,
故答案为:2Ce(OH)3+NaClO+H2O=2Ce(OH)4+NaCl;
(6)Fe2+将四价铈还原成Ce3+,Fe2+被氧化为Fe3+,根据电子转移守恒:n[Ce(OH)4]=n[(NH4)2Fe(SO4)2]=25×10-3L×0.1mol•L-1×$\frac{100ml}{20ml}$=1.25×10-2mol,则m[Ce(OH)4]=208g/mol×1.25×10-2mol=2.6 g,则产品的纯度为$\frac{2.6g}{2.68g}$×100%≈0.97,
故答案为:0.97.
点评 本题考查了Ce(OH)4的制备,为高考常见题型,侧重分析及实验能力的综合考查,注意把握物质的性质以及实验流程,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
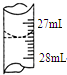 欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOHmol•L-1溶液的物质的量浓度,可用0.100的HCl标准溶液进行中和滴定(用甲基橙作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C═O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L H2和Cl2的混合气体中含有的分子数为2NA | |
| B. | 在标准状况下,1 mol H2O的体积可能是22.4 L | |
| C. | 当温度高于0℃时,一定量任何气体的体积都大于22.4 L | |
| D. | 标况下,某气体的体积为22.4 L,则该气体的物质的量为1 mol,所含的分子数目约为:6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 假说经过反复验证和修正,才发展成为科学的理论 | |
| B. | 研究物质的性质常用观察、实验、分类、比较等方法 | |
| C. | 在研究原子结构的过程中建立起的各种模型属于思维模型 | |
| D. | 依据丁达尔现象可将分散系分为溶液、胶体与浊液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com