
【题目】铜和浓硫酸反应,若生成标准状况下的气体5.6L,转移电子的物质的量为_____。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68 g,溶液质量增加0.03 g,则A合金中Cu、Zn的物质的量之比为
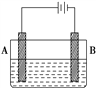
A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图所示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是____________________________________。
(3)加氧化剂X的有关离子方程式是_______________________________。
(4)加氧化剂X的目的是_____________________________________________。
(5)为什么不能直接蒸发结晶得到CuCl2·2H2O晶体?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为____________(填字母),
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应_________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
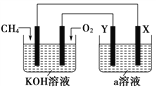
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________。
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是____________________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、X、Y、Z、W的原子序数依次增大,X和Z同主族,M和Z原子的最外层电子数均为各自所在周期数的2倍,Y的单质燃烧火焰呈黄色。下列推断正确的是
A. 简单离子的半径:Y<Z<W
B. 最简单氢化物的沸点:X<Z<W
C. 最高价氧化物对应水化物溶液的pH:W<Z<M
D. 化合物Y2M2中既有离子键也有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年科学工作若研究的两项最新成果如下:
I.4-一二甲氨基吡啶( )能高效催化醋酸酐和磺胺的反应。
)能高效催化醋酸酐和磺胺的反应。
II.钙钛矿制作的一种新材料推进了人工光合作用的进程。
请回答以下问题:
(1)基态钛原子的价电子排布式为_____________________。
(2)①构成4—二甲氨基吡啶分子的各原子电负性由大到小的顺序为_____________,其中元素第一电离能最大的是_________________。
②1mol4—二甲氨基吡啶分子中所含σ键的数目为_____________,其中C原子的杂化形式为____________。(3)乙酰氯(CH3COCl)和乙酸钠(CH3COONa)反应可以制备醋酸酐。这两种反应物中熔点更高的是_____,原因是_______________________________。
(4)自然界中除钙钛矿外,碳酸钙、硫酸钙也都是钙元素形成的常见物质。请比较键角的大小:CO32-_____SO42-(填“>”“<”或“=”),推断依据是_________________________________。
(5)钙钛矿有多种晶胞结构,其中一种晶胞结构如图所示
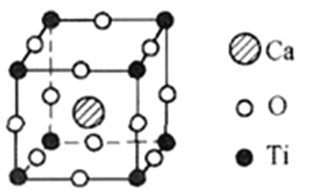
①此钙钛矿晶胞中,Ca2+周围距离最近且相等的Ca2+个数为__________________________。
②已知该晶胞的密度为d g/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数a=_______pm。(写出表达式,不需要进行计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去括号内的杂质,其试剂选择和分离方法都正确的是( )
序号 | 物质(杂质) | 所用试剂 | 分离方法 |
A | 溴苯(溴) | 苯 | 萃取分液 |
B | 甲烷(乙烯) | 溴水 | 洗气 |
C | 乙烯(SO2) | 酸性KMnO4 | 洗气 |
D | 乙醇(H2O) | 生石灰 | 过滤 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加罗常数的值,下列说法正确的是( )
A. 常温常压下,2.2gCO2中含有的分子数为0.05NA
B. 0.5molNa2CO3固体中含有的Na+数为0.5NA
C. 32 g O2所含的原子数目为NA
D. 标准状况下,2.24LCCl4含有的碳原子数为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com