
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为____________(填字母),
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应_________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
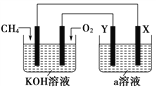
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________。
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是____________________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
【答案】 D CH4+10OH--8e-=CO32-+7H2O 将湿润的淀粉碘化钾试纸靠近Y极上方,若试纸变蓝,说明有氯气生成 白色固体迅速变为灰绿色,最后变成红褐色 0.2 mol
【解析】(1)能构成原电池的条件之一是:该反应是放热反应,即△H<O,且该反应必须是能自发进行的氧化还原反应。A、该反应是吸热反应,选项A错误;B、该反应是吸热反应且是非氧化还原反应,选项B错误;C、该反应是放热反应但是非氧化还原反应,选项C错误;D、该反应是放热反应且是能自发进行的氧化还原反应,选项D正确。答案选D;(2)以KOH溶液为电解质溶液,负极甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4+10OH--8e-=CO32-+7H2O;(3)①当石墨作电极时,阳极Y上氯离子失电子生成氯气,氯气有氧化性能和碘离子发生置换反应生成碘单质,淀粉遇碘变蓝色,所以检验氯气的方法是将湿润的淀粉KI试纸靠近Y极支管口处,试纸变蓝,说明有氯气生成;②阳极为铁电极时,阳极反应为Fe-2e-=Fe2+,所以有Fe(OH)2生成,露置在空气中时迅速变为灰绿色,最终变为红褐色;③根据“电解出什么物质加入什么物质”的方法知,加入0.1 mol CuO,所以发生电解时生成氧气和铜,根据原子守恒知:0.1mol的CuO,则相当于生成0.05mol氧气;转移的电子的物质的量为0.05mol×4 =0.2mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 甲烷分子的比例模型为![]() ,其二氯取代物有1种结构
,其二氯取代物有1种结构
B. 苯和乙烯都能使溴水褪色,其褪色原理相同
C. 相同质量的乙炔与苯分别在足量的氧气中完全燃烧,消耗氧气的物质的量相同
D. 在一定条件下,苯与氯气生成氯苯的反应类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列有关叙述正确的是( )
A. 室温下,1LpH=13的Ba(OH)2溶液中含有OH-的数目为0.2NA
B. 密闭容器中0.2molNO和0.1molO2充分反应后,分子总数为0.2NA
C. 7.8gNa2S和7.8gNa2O2中含有阴、阳离子总数均为0.3NA
D. 0.02molNa与0.1mol/L的盐酸充分反应,转移的电子数为0.01NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硝酸锶[Sr(NO3)2]可用于制作红色烟火、光学玻璃、电子管阴极材料等。由工业级硝酸锶(含有硝酸钡、硝酸钙等杂质)提取高纯硝酸锶的流程如下:

(1)滤液1中的主要溶质是___________(填化学式)。
(2)相对于水洗,滤渣1用浓硝酸洗涤的优点是________________________________。
(3)滤液2中过量的铬酸洗液被N2H4还原产生Cr3+和一种不污染环境的气体。该反应的离子方程式为______________________________________。
(4)滤渣3的主要成分是_____(填化学式);滤液3中c(Cr3+)=_____mol/L(常温下Ksp[Cr(OH)3]=6.3×10-31)。
(5)操作X为_____________;Sr(NO3)2·nH2O转化为高纯硝酸锶的过程温度要控制在100℃,目的是_________________。
(6)为测定Sr(NO3)2·nH2O的数值n,将7.44g Sr(NO3)2·nH2O晶体在100℃加热至恒重为6.36g的高纯硝酸锶。计算得n=______(M[Sr(NO3)2]=212g/mol)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
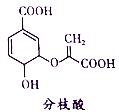
A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水溶液中逐滴加入0.1000mol/L的HCl溶液,测得混合溶液的温度变化如图。下列相关说法正确的是
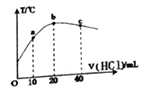
A. a、b、c点的水的电离程度依次增大
B. 判断溶液的pH:b点pH=7,c点pH<7
C. 己知25℃时0.2mol/L氨水电离度为1.33%,此时氨水的pH 约为12
D. 若a点溶液呈碱性,则a点有c(NH4+)>c(Cl-)>c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com