
【题目】在一隔热系统中,初始温度为25℃,向20.00mL0.1000mol/L的氨水溶液中逐滴加入0.1000mol/L的HCl溶液,测得混合溶液的温度变化如图。下列相关说法正确的是
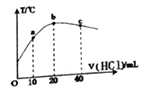
A. a、b、c点的水的电离程度依次增大
B. 判断溶液的pH:b点pH=7,c点pH<7
C. 己知25℃时0.2mol/L氨水电离度为1.33%,此时氨水的pH 约为12
D. 若a点溶液呈碱性,则a点有c(NH4+)>c(Cl-)>c(NH3·H2O)
【答案】D
【解析】A. b点恰好反应生成氯化铵,铵根水解,促进水的电离,且溶液温度最高,而酸或碱抑制水的电离,所以水的电离程度最大的是b点,A错误;B. 恰好反应时放热最多,加热促进水的电离,铵根水解,促进水的电离,则溶液的pH:b点pH<7,c点盐酸过量:pH<7,B错误;C. 己知25℃时0.2mol/L氨水电离度为1.33%,此时氨水溶液中氢氧根浓度是0.2mol/L×1.33%=0.00266mol/L,所以pH>12,C错误;D. 若a点溶液呈碱性,说明铵根的水解程度小于一水合氨的电离程度,则a点有c(NH4+)>c(Cl-)>c(NH3·H2O),D正确,答案选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为____________(填字母),
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应_________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
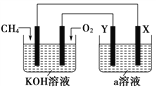
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________。
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是____________________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列溶液中的粒子浓度关系正确的是( )
A. 一定物质的量浓度的Na2S溶液中:c(OH-)=c(H+)+2c(H2S)+c(HS-)
B. 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
C. pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
D. 25℃时,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液pH=4.75,c(![]() )+c(
)+c(![]() )=c(CH3COOH)+c(H+)
)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
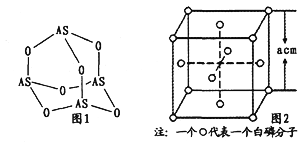
(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加罗常数的值,下列说法正确的是( )
A. 常温常压下,2.2gCO2中含有的分子数为0.05NA
B. 0.5molNa2CO3固体中含有的Na+数为0.5NA
C. 32 g O2所含的原子数目为NA
D. 标准状况下,2.24LCCl4含有的碳原子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同温同压下的两个相同容器中分别装有O2和O3气体,则两瓶气体中分子数之比是______,原子数之比是______,质量之比是______,密度之比是______
(2)下列所给出的几组物质中:含有分子数最多的是_________;含有原子数最多的是_________;标准状况下体积最大的是____________。
① 1gH2; ② 2.408×1023个CH4 ;③ 10.8gH2O; ④ 标准状况下6.72LCO2
(3)设NA表示阿伏加德罗常数,如果ag某气体含有的分子数是b,则cg该气体在标准状况下的体积是_________________(用含NA的式子表示)。
(4)配制100 mL 1mol/L的的稀H2SO4溶液,需要用量筒量取质量分数为98%的浓H2SO4(密度为1.84g/cm3)的体积为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
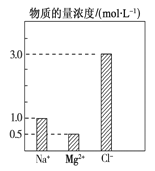
A. NaCl的物质的量为0.1mol
B. 该混合液中BaCl2的物质的量为0.05mol
C. 溶质MgCl2的质量为9.5 g
D. 将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量的浓度为0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据下表有关铁难溶化合物的溶度积,有关说法正确的是
化合物 | 溶度积(25℃) | 化合物 | 溶度积(25℃) |
FeCO3 | 3.2×10-11 | Fe(OH)3 | 4.0×10-38 |
Fe(OH)2 | 8.0×10-11 | FeS | 6.3×10-18 |
A. 在c(CO32-)=0.1 mol·L-1的溶液中,c(Fe2+)≥3.2×10-10 mol·L-1
B. 将FeCl3和 FeCl2溶液分别调至PH=10,则c(Fe2+)< c(Fe3+)
C. 增加溶液的酸性,有利于将Fe2+沉淀为FeS和FeCO3
D. 将反应液中的Fe2+氧化为 Fe3+有利于将铁从溶液中除尽
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com