
【题目】物质结构与性质]单质铁、锂、砷及它们的化合物广泛应用于超导体材料等领域,回答下列问题:
(1)Fe原子的核外电子排布式为[Ar]_________,Li原子核外占据最高能层电子的电子云轮廓图形状为_________。
(2)As 的卤化物的熔点如下:
AsCl3 | AsBr3 | AsI3 | |
熔点/K | 256.8 | 304 | 413 |
表中卤化物熔点差异的原因是_________,AsCl3分子的立体构型为_________。
(3)铁、锂、砷形成的化合物LiFeAs是一种超导体,其晶胞结构如图1所示,已知立方晶胞参数acm,则该晶休的密度是_________g/cm3(用含a、NA的式子表示)。


(4)向FeCl3溶液中滴入EDTA试剂可得配合物A,其结构如图2所示,图中M代表Fe3+。则1号碳原子有_______个σ键,2号碳原子采取_________杂化方式;Fe3+与氮原子之间形成的化学键是_________,Fe3+的配位数为_________;该配合物中,第二周期的三种元素的第一电离能由大到小的顺序为_________。
【答案】 3d64s2 球形 对于组成和结构相似物质,相对分子质量逐渐增大,分子间作用力逐渐增强,熔点逐渐升高 三角锥形 ![]() 4 sp2 配位键 6 N>O>C
4 sp2 配位键 6 N>O>C
【解析】(1)本题考查电子排布式书写、电子云形状,Fe属于26号元素,因此核外电子排布式为[Ar]3d64s2;Li的电子排布式为1s22s1,最高能层电子的能级为s,电子云的轮廓图为球形;(2)本题考查物质熔沸点高低判断、立体构型,AsCl3、AsBr3、AsI3组成和结构相似,相对分子质量大小顺序是AsI3>AsBr3>AsCl3,相对分子质量越大,范德华力越大,熔沸点越高;AsCl3中心原子As,有3个σ键,孤电子对数为(5-3×1)/2=1,价层电子对数为4,因此AsCl3的立体构型为三角锥形;(3)本题考查晶胞的计算,根据晶胞结构,Fe位于晶胞的顶点、棱上和面心,个数为8×1/8+2×1/2+8×1/4=4,As位于晶胞内部,个数有4个,Li位于晶胞内部,有4个,因此晶胞的质量为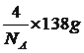 ,晶胞的体积为a3cm3,根据密度的定义,因此该晶胞的密度为
,晶胞的体积为a3cm3,根据密度的定义,因此该晶胞的密度为![]() g/cm3;(4)本题考查共价键、杂化类型判断、配位键、电离能规律,根据图2,1号碳原子含有4个σ键,2号碳原子有3个σ键,无孤电子对,价层电子对数为3,即杂化类型为sp2;一个N原子形成三个共价键,达到“饱和”,现在N有4个键,因此Fe3+和N之间形成的化学键为配位键;根据图2,Fe3+配位数为6;同周期从左向右第一电离能逐渐增大,但IIA>IIIA、VA>VIA,因此第一电离能的大小是N>O>C。
g/cm3;(4)本题考查共价键、杂化类型判断、配位键、电离能规律,根据图2,1号碳原子含有4个σ键,2号碳原子有3个σ键,无孤电子对,价层电子对数为3,即杂化类型为sp2;一个N原子形成三个共价键,达到“饱和”,现在N有4个键,因此Fe3+和N之间形成的化学键为配位键;根据图2,Fe3+配位数为6;同周期从左向右第一电离能逐渐增大,但IIA>IIIA、VA>VIA,因此第一电离能的大小是N>O>C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.糖类、油脂、蛋白质都能发生水解反应
B.油脂、蛋白质都是由
C.H、O三种元素组成的C.糖类、油脂、蛋白质都是高分子化合物
D.油脂有油和脂肪之分,都属于酯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.常温下,浓硝酸和浓硫酸都不与铁、铝反应
B.氨易液化,液氨常用作制冷剂
C.活泼金属和稀硝酸反应时置换出氢气
D.与金属反应时,稀硝酸可能被还原为更低价态,稀硝酸氧化性强于浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
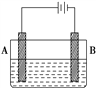
【题目】按如图所示的装置进行实验:A极是铜锌合金,B极是纯铜,电解质溶液中含有足量的铜离子,通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68 g,溶液质量增加0.03 g,则A合金中Cu、Zn的物质的量之比为
A. 4∶1 B. 3∶1 C. 2∶1 D. 1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将MgCl2·xH2O的晶体4.06g溶于水配成100mL溶液,此溶液50mL正好与50mL0.4mol/L的AgNO3溶液完全作用。由上述数据计算
(1)4.06g的MgCl2·xH2O物质的量______。
(2)式中x的数值______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2、KMnO4、NaClO、K2Cr2O7均具有强氧化性。将溶液中的Cu2+、Fe2+、Fe3+沉淀为氢氧化物,需溶液的pH分别为6.4、9.6、3.7。现有含FeCl2杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按图所示步骤进行提纯:

请回答下列问题:
(1)本实验最适合的氧化剂X是________(填序号)。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(2)物质Y是____________________________________。
(3)加氧化剂X的有关离子方程式是_______________________________。
(4)加氧化剂X的目的是_____________________________________________。
(5)为什么不能直接蒸发结晶得到CuCl2·2H2O晶体?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为____________(填字母),
A.C(s)+H2O(g)===CO(g)+H2(g) ΔH>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) ΔH>0
C.CaC2(s)+2H2O(l)===Ca(OH)2(s)+C2H2(g) ΔH<0
D.CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH<0
(2)以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应_________________。
(3)电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
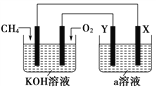
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是____________________________________。
②若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是____________________________________________。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 mol CuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年科学工作若研究的两项最新成果如下:
I.4-一二甲氨基吡啶( )能高效催化醋酸酐和磺胺的反应。
)能高效催化醋酸酐和磺胺的反应。
II.钙钛矿制作的一种新材料推进了人工光合作用的进程。
请回答以下问题:
(1)基态钛原子的价电子排布式为_____________________。
(2)①构成4—二甲氨基吡啶分子的各原子电负性由大到小的顺序为_____________,其中元素第一电离能最大的是_________________。
②1mol4—二甲氨基吡啶分子中所含σ键的数目为_____________,其中C原子的杂化形式为____________。(3)乙酰氯(CH3COCl)和乙酸钠(CH3COONa)反应可以制备醋酸酐。这两种反应物中熔点更高的是_____,原因是_______________________________。
(4)自然界中除钙钛矿外,碳酸钙、硫酸钙也都是钙元素形成的常见物质。请比较键角的大小:CO32-_____SO42-(填“>”“<”或“=”),推断依据是_________________________________。
(5)钙钛矿有多种晶胞结构,其中一种晶胞结构如图所示
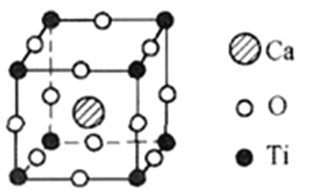
①此钙钛矿晶胞中,Ca2+周围距离最近且相等的Ca2+个数为__________________________。
②已知该晶胞的密度为d g/cm3,NA表示阿伏加德罗常数的值。计算晶胞参数a=_______pm。(写出表达式,不需要进行计算)
查看答案和解析>>
科目:高中化学 来源: 题型:
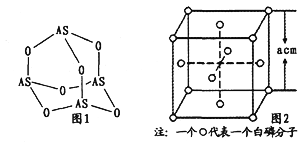
【题目】【化学-选修3:物质结构与性质】张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为_______;As原子的核外电子排布式为______________。
(2)NH3的沸点比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化学键类型包括_______;AsO43-的空间构型为_______,As4O6的分子结构如图1所示,则在该化合物中As的杂化方式是_________。
(4)白磷(P4)的晶体属于分子晶体,其晶胞结构如图2(小圆圈表示白磷分子)。己知晶胞的边长为acm,阿伏加德罗常数为NAmol-1,则该晶胞中含有的P原子的个数为______,该晶体的密度为___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com