
【题目】关于常温下0.1![]() 醋酸钠溶液,下列说法正确的是( )
醋酸钠溶液,下列说法正确的是( )
A. 该溶液中水电离出来的![]()
B. 溶液中离子浓度关系:![]()
C. 该溶液的![]()
D. 加入等浓度等体积的盐酸,溶液中:![]()
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】生物体中某些有机物及元素组成如下图。其中x、y代表化学元素,a、b、c、d代表不同的有机小分子,A、B、C、D、E代表不同的生物大分子,请据图分析回答:

(1)若A为动物特有的储能物质,则A表示的物质是________;若A为植物细胞壁的组成成分之一,则A表示的物质是________。
(2)多个b可通过脱水缩合形成B,则x为______,连接两个b的化学键的结构简式是_____。
(3)大肠杆菌的遗传物质是_______(用图中字母回答),它的细胞器由B和_______组成(用图中字母回答),其体内单体c有_______种。
(4)在真核生物体内,A、B、D、E中可能具有催化作用的是________。
(5)若d为____________,其作用是促进人和动物生殖器官的发育以及生殖细胞的形成;若d为维生素D,其作用是有效促进人和动物肠道对_______________的吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组溶液中的各种溶质的物质的量浓度均为0.1 mol/L。①H2S溶液;②KHS溶液;③K2S溶液;④H2S和KHS混合溶液。 下列说法正确的是
A. 溶液pH从大到小的顺序是:③ > ② > ① > ④
B. 在KHS溶液中有:c(H+) + c(K+) = c(OH-) + c(HS-) + c(S2-)
C. c(H2S)从大到小的顺序是:① > ④ > ③ > ②
D. 在H2S和KHS混合溶液中有:c(H2S) + c(HS-) + c(S2-) = 2c(K+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物说法正确的是( )
A. 甲烷、乙烯和苯的分子中原子都在同一平面上
B. 苯和乙烯都可使溴的四氯化碳溶液褪色
C. 甲烷、乙烯、乙醇都能发生氧化反应
D. 植物油属于高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. ![]() 溶液和
溶液和![]() 溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
溶液加热、蒸发、浓缩、结晶、灼烧,所得固体的成分相同
B. 配制![]() 溶液时,将
溶液时,将![]() 固体溶解在硫酸中,然后再用水稀释到所需的浓度
固体溶解在硫酸中,然后再用水稀释到所需的浓度
C. ![]() 溶液不可保存在带磨口玻璃塞的玻璃瓶中
溶液不可保存在带磨口玻璃塞的玻璃瓶中
D. 泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.回答下列问题:
(1)欲量取20.00 mL KMnO4酸性溶液,应选用的仪器是________________。
(2)中和热测定的实验中,用到的玻璃仪器有烧杯、温度计、_____________、___________。
(3)在测定硫酸铜晶体中结晶水含量的实验中,称量操作至少要进行__________次。
II.氢氧化铜是一种常用试剂。例如,利用新制氢氧化铜验证醛类物质的还原性。
(1)新制氢氧化铜悬浊液的配制。实验室制取氢氧化铜悬浊液的操作方法:在试管里加入10%的氢氧化钠溶液2 mL,滴入2%的硫酸铜溶液4~6滴,振荡即成。这样操作的目的是________________________________________________________________________________。
下面是三个研究性学习小组分别从不同层面开展的研究性学习活动:
(2)研究性学习小组甲:对教材实验结论“乙醛与新制氢氧化铜反应生成的红色沉淀是Cu2O”提出质疑,他们认为红色沉淀不一定是氧化亚铜。为了确定红色沉淀的成分,开展了如下研究,提出猜想:_______________________________________________。
查阅资料:①氧化亚铜属于碱性氧化物;②+1价的铜离子在酸性条件下易发生自身氧化还原反应,生成+2价的铜离子和单质铜;③在空气中灼烧氧化亚铜生成氧化铜。
设计方案:
方案1:取该红色沉淀溶于足量的稀硝酸中,观察溶液颜色变化。
方案2:取该红色沉淀溶于足量的稀硫酸中,观察是否有残渣。
方案3:称取红色沉淀a g,在空气中充分灼烧至完全变黑,并在干燥器里冷却,再称量,反复多次至固体恒重,称得质量为b g,比较a、b关系。
方案4:取该红色固体沉淀装入试管里,加入酸化的硝酸银溶液,观察是否有银白色银析出。
你认为合理的方案是____________________________。
(3)研究性学习小组乙针对甲的质疑,设计新的探究方案,装置如下图所示。
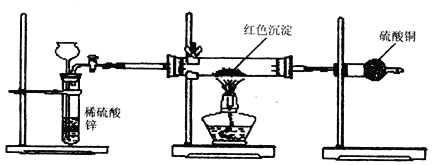
你认为要测定上述红色沉淀成分必须测定下列哪些物理量(只填序号):________________。
①通入氢气体积;②反应前,红色沉淀 + 硬质玻璃管的总质量;③完全反应后红色固体 + 硬质玻璃管的总质量;④实验前,干燥管质量;⑤硬质玻璃管质量;⑥锌粒质量;⑦稀硫酸中含溶质的量;⑧实验后,干燥管质量。
(4)研究性学习小组丙上网查阅新闻得知:“2005年诺贝尔化学奖授予了三位研究绿色化学的科学家”。绿色化学强调对环境友好,实现零排放。“变废为宝”符合绿色化学要求。他们收集上述红色沉淀制备化学试剂:蓝矾。请你帮助他们设计一个简单且符合绿色化学要求的实验方案:____________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其他试剂,用最简单的方法鉴别下列物质 ①NaOH溶液 ②Mg(NO3)2溶液 ③CuSO4溶液 ④KCl溶液;
正确的鉴别顺序是( )
A.①②③④
B.③④②①
C.④①②③
D.③①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,在H2C2O4、NaOH混合溶液中,c(H2C2O4)-c(HC2O4-)+c(C2O42-)=0.100mol/L。含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。下列说法正确确是
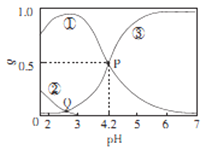
A. ①表示H2C2O4的分布曲线,③表示C2O42-的分布曲线
B. 20℃时,H2C2O4的二级电离平衡常数Ka=1×10-4.2
C. Q点对应溶液中lgc(H+)<lgc(OH-)
D. 0.100mol/L的NaHC204溶液中:c(OH-)=c(H+)-2c(C2042-)+c(H2C2O4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com