
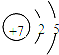 ,R为Cl元素,最高价氧化物对应水化物的化学式为HClO4,
,R为Cl元素,最高价氧化物对应水化物的化学式为HClO4,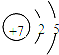 ;HClO4;
;HClO4;

科目:高中化学 来源: 题型:
| A、向铁粉中加入足量稀硝酸:2Fe+6H+═2Fe3++3H2↑ |
| B、向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O |
| C、向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-═I-+3SO42-+3H+ |
| D、向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-═CO32-+NH3?H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、239Pu比235U原子核内多4个中子 |
| B、核反应堆中使用的重水与水互为同位素 |
| C、石油、天然气等化石燃料属于可再生能源 |
| D、合理使用核能可有效减少温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:
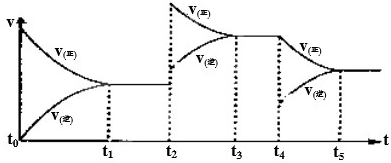
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 500 | 700 | 850 | 1 000 |
| 平衡常数 | 2.5 | 1.7 | 1.0 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com