氮是一种非常重要的元素,它的单质和化合物应用广泛,在科学技术和生产中有重要的应用.试回答下列问题:
(1)N
2和H
2为原料合成氨气的反应为:N
2(g)+3H
2(g)?2NH
3(g)△H<0,下列措施可以提高H
2的转化率是(填选项序号)
.
a.选择适当的催化剂 b.增大压强 c.及时分离生成的NH
3 d.升高温度
(2)在恒温条件下,将N
2与H
2按一定比例混合的气体充入一个2L固定容积的密闭容器中,10分钟后反应达平衡时,n(N
2)=1.0mol,n(H
2)=1.0mol,n(NH
3)=0.4mol,则反应速率v(N
2)=
mol/(L?min),平衡常数K=
.
(3)在容积恒定的密闭容器中进行反应2NO(g)+O
2(g)?2NO
2(g)△H>0
该反应的反应速率(v)随时间(t)变化的关系如图所示.若t
2、t
4时刻只改变一个条件,下列说法正确的是(填选项序号)
.
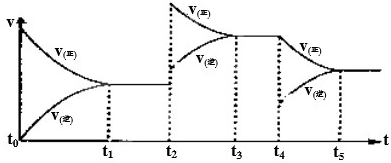
a.在t
1-t
2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t
2时,采取的措施一定是升高温度
c.在t
3-t
4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t
0-t
5时,容器内NO
2的体积分数在t
3时值的最大
(4)氨和联氨(N
2H
4)是氮的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式:
.
(5)已知:N
2(g)+O
2(g)═2NO(g)△H=+180.5kJ/mol
N
2(g)+3H
2(g)?2NH
3(g)△H=-92.4kJ/mol
2H
2(g)+O
2(g)═2H
2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为
.
(6)直接供氨式碱性燃料电池的电池反应式是4NH
3+3O
2═2N
2+6H
2O,电解质溶液一般使用KOH溶液,则负极电极反应式是
.从理论上分析,该电池工作过程中
(填“需要”或“不需要”)补充碱(KOH).




 按如图所示装置,能形成原电池.下列说法正确的是( )
按如图所示装置,能形成原电池.下列说法正确的是( ) 将如图所示实验装置的K闭合,下列判断不正确的是( )
将如图所示实验装置的K闭合,下列判断不正确的是( )