
【题目】等质量的下列烷烃,完全燃烧消耗氧气最多的是( )
A.CH4B.C2H6C.C3H8D.C6H14
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】塑化剂是一种对人体有害的物质。增塑剂DCHP可由邻苯二甲酸酐与环已醇反应制得。下列说法不正确的是

A. DCHP的分子式为C20H26O4
B. 该反应属于取代反应
C. DCHP的一氯取代产物有6种
D. 与环已醇分子式相同,且具有醛基(-CHO)的结构共有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
早期发现的一种天然二十面体准晶颗粒由三种Al、Cu、Fe三种金属元素组成。回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______________方法区分晶体、准晶体和非晶体。
(2)基态Fe原子有_________个未成对电子,Fe3+的电子排布式为_______________。可用硫氰化钾检验Fe3+,形成的配合物的颜色为_______________。
(3)新制的Cu(OH)2可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙醛中碳原子的杂化轨道类型为____________,乙醛分子中各元素的电负性由大到小的顺序为_______________。乙酸的沸点明显高于乙醛,其主要原因是_____________________________。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有___________个铜原子。
(4)Al单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为__________。列式表示Al单质的密度_______________ g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应C(s)+H2O(g)![]() CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是
CO(g)+H2(g)△H>0,测得c(H2O)随反应时间(t)的变化如图。下列判断正确的是

A.5 min时该反应的K值一定小于12 min时的K值
B.0~5 min内,v(H2)=0.05 mol/(L·min)
C.10 min时,改变的外界条件可能是减小压强
D.该反应混合气体的平均相对分子质量:5 min时小于12 min 时的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲乙两种固体的溶解度曲线如右图所示。有一个大烧杯中装着含有甲和乙的两种饱和溶液,而且杯中还有少量甲和乙的固体存在,现将温度由80℃降到20℃。下列说法错误的是( )
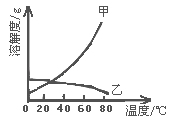
A. 杯中固体甲增多、固体乙减少
B. 杯中一定有固体甲而不一定有固体乙
C. 溶液中溶质甲减少、溶质乙增多
D. 甲和乙的两种溶液仍然一定是饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁分析中常用过硫酸盐氧化法测定钢中锰的含量,反应原理为:
2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(1)现代化学中,常利用_________上的特征谱线来鉴定元素
(2)试从分子的立体构型和原子的电负性、中心原子上的孤电子对等角度解释为什么与水结构十分相似的OF2的极性很小?______________________。
(3)己知H2S2O8的结构如图。
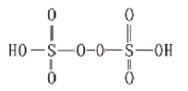
①H2S2O8硫原子的轨道杂化方式为________________。上述反应中被还原的元素为_____________。
②S基态原子中电子的空间运动状态有________________ 种。
③上述反应每生成1 mol MnO4-,S2O82-断裂的共价键类型及其数目为___________、__________。
(4)一定条件下,水分子间可通过氢键将从H2O分子结合成三维骨架结构,其中的多面体孔穴中可包容气体小分子,形成笼形水合包合物晶体。
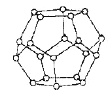
①如图是一种由水分子构成的正十二面体骨架(“o”表示水分子),其包含的氢键数为__________;
②实验测得冰中氢键的作用能为18.8kJ·mol-1,而冰的熔化热为5.0kJ·mol-1,其原因可能是__________。
(5)底心晶胞的特征是:将晶胞的框架的顶角移至晶胞的某一对面的中心所得的新晶胞与原晶胞无差别。在晶体学上底心平移的符号是+ (1/2,1/2,0) (C底心);或+ (0,1/2,1/2) (A底心);或+ (1/2,0,1/2) (B底心)。底心平移是指其中之一。

则:I2是_______(填“A”、“B”或“C”)底心晶胞.
(6)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图(a)所示,并给出了一个石墨的六方晶胞如图(b)所示。
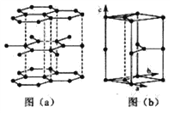
①在图中画出晶胞沿C轴的投影(用“●” 标出碳原子位置即可)_______________;
标出碳原子位置即可)_______________;
②假设石墨的层间距为300 pm。C-C键长为150 pm。计算石墨晶体的密度为______g· cm-3(碳元素的相对质量为12,NA=6.0×1023,计算结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,在指定的环境中一定能大量共存的是( )
A. 在pH为7的溶液中:Ag+、K+、SO![]() 、Cl-
、Cl-
B. 在能使pH试纸变深蓝色的溶液中:Na+、S2-、NO![]() 、CO
、CO![]()
C. 在加入铝粉能产生H2的溶液中:NH![]() 、Fe2+、SO
、Fe2+、SO![]() 、NO
、NO![]()
D. 在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Mg2+、Cl-、I-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是 ( )
A.有单质生成的反应一定是氧化还原反应
B.焰色反应是元素表现出来的化学性质
C.由两种元素组成,原子个数比为1:1的物质一定是纯净物
D.能与酸反应产物中有盐和水的氧化物不一定是碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com