
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号)。
(2)铜晶体中铜原子的堆积方 式如图1所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是______________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为__________________pm。
【答案】 1 正四面体 sp3 Mg 面心立方密堆积 CuCl Cu+可与氨形成易溶于水的配位化合物(或配离子) [Cu(NH3)4]2+ 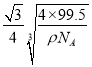 ×1010
×1010
【解析】(1)①Ti3+的基态原子核外电子排布式为:1s22s22p63s22p63d1,未成对电子数有1个;②BH4-中B原子价层电子数=4+(3+1-4×1)/2=4,且不含孤电子对,所以是正四面体构型,B原子的杂化轨道类型是sp3;③根据表中数据可知第三电离能远大于第二电离能,所以是第ⅡA族元素,M是Mg;(2)根据示意图可知铜晶体中原子的堆积模型属于面心立方最密堆积;(3)根据价电子排布式判断出A原子为Cl原子;①由晶胞结构可知,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,Cl原子属于顶点与面心上,晶胞中含有Cl原子数目为8×1/8+6×1/2=4,故化学式为CuCl;②由于Cu+可与氨形成易溶于水的配位化合物(或配离子),所以该化合物难溶于水但易溶于氨水;此化合物的氨水溶液遇到空气则被氧化为深蓝色,这说明有铜离子生成,则深蓝色溶液中阳离子的化学式为[Cu(NH3)4]2+;③一个晶胞的摩尔质量为4×99.5g/mol,晶胞摩尔体积为4×99.5,晶胞的边长为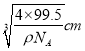 ,根据晶胞的结构可知,铜原子和A原子之间的最短距离为立方体体对角线的1/4,而体对角线为晶胞边长的
,根据晶胞的结构可知,铜原子和A原子之间的最短距离为立方体体对角线的1/4,而体对角线为晶胞边长的![]() 倍,所以铜原子和A原子之间的最短距离为
倍,所以铜原子和A原子之间的最短距离为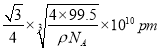 。
。


科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手。
Ⅰ.研究发现,NOx是雾霾的主要成分之一,NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=180.50 kJ·mol-1
2NO(g) ΔH=180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00 kJ·mol-1
2CO2(g) ΔH=-566.00 kJ·mol-1
为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环,写出该反应的热化学方程式:_____________。
Ⅱ.开发利用清洁能源可减少污染,解决雾霾问题。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景,一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2 L密闭容器中充入物质的量之比为1∶2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。
CH3OH(g),在2 L密闭容器中充入物质的量之比为1∶2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。

(1)该反应的反应热ΔH________(填“>”或“<”)0,压强的相对大小与p1________(填“>”或“<”)p2。
(2)该反应化学平衡常数表达式为___________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________(填字母)。
A.容器内气体压强不再变化
B.v(CO)∶v(H2)∶v(CH3OH)=1∶2∶1
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下,在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的依据是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于醋酸钠溶液的说法中正确的是
A. 溶液呈酸性
B. c(H+)= c(CH3COO-)+ c(OH-)
C. c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D. c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
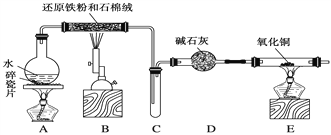
(1)A装置的作用是________________。
(2)写出装置B中发生反应的化学方程式:_______________________________________。
(3)D的作用是_________________________________________________________________。
(4)E中的实验现象是________。
(5)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于[Cr(H2O)4Br2]Br·2H2O的说法正确的是
A.配体为水分子,外界为 Br-
B.中心离子的配位数为6
C.中心原子采取sp3杂化
D.中心离子的化合价为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一定量的Fe、FeO、Fe2O3混合物中加入100 mL 1 mol/L盐酸,恰好使混合物完全溶解,放出224 mL(标准状况下)的气体,在所得溶液中加入KSCN溶液,无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,可得到铁的质量是( )
A. 11.2g B. 5.6g C. 2.8g D. 无法计算
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列属于自然固氮的是
A.N2和O2在雷电作用下生成NO B.某金属化合物将氮气转化为化合态氮
C.在一定条件下使N2、H2合成NH3 D.NO生成NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完全沉淀相同体积的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗相同浓度的AgNO3溶液的体积之比为3∶2∶1,则NaCl、MgCl2、AlCl3溶液的物质的量浓度之比为( )
A. 1∶2∶3 B. 3∶2∶1 C. 9∶3∶1 D. 6∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。A为含硫氮正盐其中硫元素化合价为+4,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。试回答下列问题:

(1)写出下列物质化学式:D:__________;F:__________。
(2)写出下列反应的离子方程式:
①A和酸性KMnO4溶液反应__________;
②D和新制氯水:__________。
(3)通过本题的解答,在检验SO42-时,应使用__________。
A.盐酸酸化的BaCl2溶液 B.硝酸酸化的Ba(NO3)2溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com