
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
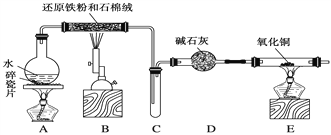
(1)A装置的作用是________________。
(2)写出装置B中发生反应的化学方程式:_______________________________________。
(3)D的作用是_________________________________________________________________。
(4)E中的实验现象是________。
(5)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是______________________________________。
【答案】 产生水蒸气 3Fe + 4H2O(g)![]() Fe3O4 +4H2 吸收未反应的水蒸气 黑色固体变成红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
Fe3O4 +4H2 吸收未反应的水蒸气 黑色固体变成红色,右端管壁有水珠生成 A 收集H2,并检验其纯度
【解析】(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是产生水蒸气;(2)B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为3Fe + 4H2O(g)![]() Fe3O4 +4H2;(3)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此装置D的作用是吸收未反应的水蒸气,干燥氢气;(4)氢气还原氧化铜得到铜和水,即H2+CuO
Fe3O4 +4H2;(3)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此装置D的作用是吸收未反应的水蒸气,干燥氢气;(4)氢气还原氧化铜得到铜和水,即H2+CuO![]() Cu+H2O,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(5)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度,方法是:收集一试管气体,将试管口靠近酒精灯火焰,若发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯。
Cu+H2O,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;(5)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度,方法是:收集一试管气体,将试管口靠近酒精灯火焰,若发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下[已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1]。
2SO3(g) ΔH=-196.6 kJ·mol-1]。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2 mol SO2+1 mol O2 | 1 mol SO2+0.5 mol O2 | 2 mol SO3 | 2 mol SO2+2 mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时 c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A. a=c;e=g B. a>2b;e>2f
C. a>d;e>h D. c+98.3e>196.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素化合物性质的叙述正确的是
A. Fe在少量Cl2中燃烧生成FeCl3
B. Al2O3和Fe2O3均可与NaOH溶液反应
C. SiO2与酸、碱均不发生反应
D. 二氧化硫、氯水均有漂白作用,其原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有三种可溶性物质A、B、C,其中A、B是盐,C是碱,它们溶于水后电离产生的所有离子如下表所示:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
请根据下列叙述回答问题:
(1)C的化学式为_____________。
(2)A溶液与B溶液反应可生成气体X,则X的化学式为_______,该反应的离子方程式为____________________________________。
(3)A、B溶液与C溶液反应可分别生成白色沉淀D和E,其中D可溶于稀硝酸。
①B的化学式为____________,如何鉴别B中的阴离子________________________。
②D溶于稀硝酸的离子方程式为____________________________________________。
③D与E的混合物a克,加入足量盐酸,完全反应生成的气体在标准状况下体积为b升,求E在混合物中的质量分数 _____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上真空炼铷的原理为2RbCl+Mg![]() MgCl2+2Rb(g),下列说法正确的是( )
MgCl2+2Rb(g),下列说法正确的是( )
A.镁的金属活动性比铷强,故镁可置换铷
B.铷的沸点比镁低,把铷蒸气抽出时,平衡右移
C.MgCl2的热稳定性比RbCl弱
D.Rb单质比RbCl更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(l)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。
①基态Ti3+的未成对电子数有______个。
②LiBH4由Li+和BH4-构成,BH4-的空间构型是________,B原子的杂化轨道类型是_____________。
③某储氢材料是第三周期金属元素M的氢化物,M的部分电离能如下表所示:
I1/ kJ·mol-1 | I2/ kJ·mol-1 | I3/ kJ·mol-1 | I4/ kJ·mol-1 | I5/ kJ·mol-1 |
738 | 1451 | 7733 | 10540 | 13630 |
M是_____ (填元素符号)。
(2)铜晶体中铜原子的堆积方 式如图1所示,铜晶体中原子的堆积模型属于______。

(3)A原子的价电子排布式为3s23p5,铜与A形成化合物的晶胞如图2所示(黑点代表铜原子)。
①该晶体的化学式为______________________。
②该化合物难溶于水但易溶于氨水,其原因是______________。此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______。
③已知该晶体的密度为pg . cm-3,阿伏伽德罗常数为NA,已知该晶体中Cu原子和A原子之间的最短距离为体对角线的1/4,则该晶体中Cu原子和A原子之间的最短距离为__________________pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中可以大量共存的是
A. pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
B. 加入Al放出H2的溶液中:SO42-、NH4+、Na+、F-
C. pH=7的溶液中:SO32-、Na+、K+、ClO—
D. 无色溶液中:K+、SO42-、Cu2+、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
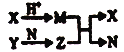
A. 相对分子质量M>N,沸点M>N B. 简单离子半径:D>B>C>A
C. Z 为 Na2CO3 D. 图中有两个氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com