
【题目】在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下[已知2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-196.6 kJ·mol-1]。
2SO3(g) ΔH=-196.6 kJ·mol-1]。
容器 | 甲 | 乙 | 丙 | 丁 |
起始投料量 | 2 mol SO2+1 mol O2 | 1 mol SO2+0.5 mol O2 | 2 mol SO3 | 2 mol SO2+2 mol O2 |
反应放出或吸收的热量(kJ) | a | b | c | d |
平衡时 c(SO3) (mol·L-1) | e | f | g | h |
下列关系正确的是( )
A. a=c;e=g B. a>2b;e>2f
C. a>d;e>h D. c+98.3e>196.6
【答案】B
【解析】A.甲容器起始时反应向正反应方向进行,而丙容器起始时反应向逆反应方向进行,虽然最后是等效平衡,但a+c=196.6,故A不正确;B.若将甲容器扩大为原来的2倍,则达平衡时甲与乙容器的浓度相等,但放出的热量是乙的2倍,现将甲容器再恢复为原来的体积,即加压,平衡向正反应方向移动,则放热又增多,故有a>2b,同理有e>2f,故B正确;C.丁中的O2可看作是在甲平衡后再充入1 mol O2,则平衡正向移动,放热增多,即有a<d,同时有e<h,故C不正确;D.根据反应: 2SO2+O2=2SO3△H=-196.6 kJmol-1
2 196.6
e a
解得a=98.3e,由选项A解析可知,a+c=196.6,即98.3e+c=196.6,故D不正确;故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A.碳酸氢钠能与碱反应,可用作食品膨松剂
B.MgO的熔点很高,可用于制作耐高温材料
C.二氧化硫具有漂白性,可用其水溶液吸收溴蒸气
D.氯化铁溶液呈酸性,可用于蚀刻铜电路板
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入2mol SO2和1molO2,发生下列反应:2SO2(g)+O2(g) ![]() 2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
2SO3(g),达到平衡后改变下述条件,SO3气体平衡浓度不改变的是
A.保持温度和容器体积不变,充入1mol SO2(g)
B.保持温度和容器内压强不变,充入1mol SO3(g)
C.保持温度和容器内压强不变,充入1mol O2(g)
D.保持温度和容器内压强不变,充入1mol Ar(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做化学实验必须注意实验安全。下列做法正确的是
A. 金属钠保存在四氯化碳中 B. 制氯气在通风橱中进行
C. 金属钠着火用小苏打干粉灭火 D. 发生火灾拨打110报警电话
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室欲用固体NaOH来配制0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯 ②100 mL量筒 ③1000 mL容量瓶 ④500 mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码)
(1)配制时,必须使用的仪器有____________(填代号),还缺少的玻璃仪器是___________________________________。
(2)实验两次用到玻璃棒,其作用分别是:______________、______________。
(3)配制时,一般可分为以下几个步骤:①称量 ②计算 ③溶解 ④摇匀 ⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为______________。
(4)在配制过程中,若其它操作均正确,下列操作会引起结果偏低的是______________。
A.没有洗涤烧杯和玻璃棒
B.未等NaOH溶液冷却至室温就转移到容量瓶中
C.容量瓶不干燥,含有少量蒸馏水
D.定容时俯视标线 E.称量时间过长
(5)用配制好的溶液,再来配制50mL 0.2mol/L的NaOH溶液,需要取原配好的溶液____mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有镁和铁的混合物共4.0克,与200毫升盐酸恰好完全反应,在标准状况下共收集到2.24L气体。假设反应后溶液体积不变,则铁的质量为_____g;反应后溶液中Mg2+的物质的量浓度为_______。
(2)一定量氢气在氯气中燃烧,所得混合气体用 100 mL、2.00 moL·L-1NaOH 溶液恰好完全吸收,测得溶液中含有 NaClO 的物质的量为 0.05mol。试计算下列问题: 所得溶液中 Cl-的物质的量为_______ ;所用氯气和参加反应的氢气的物质的量之比n(C12):n(H2)为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手。
Ⅰ.研究发现,NOx是雾霾的主要成分之一,NOx主要来源于汽车尾气。
已知:N2(g)+O2(g)![]() 2NO(g) ΔH=180.50 kJ·mol-1
2NO(g) ΔH=180.50 kJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.00 kJ·mol-1
2CO2(g) ΔH=-566.00 kJ·mol-1
为了减轻大气污染,人们提出在汽车尾气排气管口采用催化剂将NO和CO转化成无污染气体参与大气循环,写出该反应的热化学方程式:_____________。
Ⅱ.开发利用清洁能源可减少污染,解决雾霾问题。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景,一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2 L密闭容器中充入物质的量之比为1∶2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。
CH3OH(g),在2 L密闭容器中充入物质的量之比为1∶2的CO和H2,在催化剂作用下充分反应。平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如下图所示。

(1)该反应的反应热ΔH________(填“>”或“<”)0,压强的相对大小与p1________(填“>”或“<”)p2。
(2)该反应化学平衡常数表达式为___________________。
(3)下列各项中,不能说明该反应已经达到平衡的是________(填字母)。
A.容器内气体压强不再变化
B.v(CO)∶v(H2)∶v(CH3OH)=1∶2∶1
C.容器内的密度不再变化
D.容器内混合气体的平均相对分子质量不再变化
E.容器内各组分的质量分数不再变化
(4)某温度下,在保证H2浓度不变的情况下,增大容器的体积,平衡________(填字母)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
作出此判断的依据是____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了探究活动:
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是_________。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除![]() 外还可能含有
外还可能含有![]() 。若要确认其中的
。若要确认其中的![]() ,应先用_______(选填序号)。
,应先用_______(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性![]() 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
![]() 然后加入足量
然后加入足量![]() 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中![]() 的体积分数为____________。
的体积分数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行“铁与水反应”的实验,并检验产物的性质,请回答下列问题:
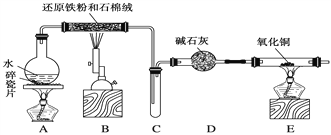
(1)A装置的作用是________________。
(2)写出装置B中发生反应的化学方程式:_______________________________________。
(3)D的作用是_________________________________________________________________。
(4)E中的实验现象是________。
(5)A、B两个装置中应先点燃________处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是______________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com