
����Ŀ��CO2���ۺ����ö��ڼ����������塢������Դ��ȱ������Ҫ�����塣
����CO2�������ȶ��������ʽΪ___��
���ྦྷCu��Ψһ��ʵ��֤ʵ�ܸ�Ч��CO2��ԭΪ����(��CH4 ��C2H4)�Ľ��������װ�÷ֱ��ԶྦྷCu�Ͳ�Ϊ�缫���ϣ��������ӽ���Ĥ�ָ������������ң����������ҵ�KHCO3��Һ��Ũ��(Լ0.1 mol/L����)�������ֲ��䡣����ij�����ڳ���ͨ��CO2���¶ȿ�����10�����ҡ�
(1)����ͨ��CO2��ԭ����______��
(2)�о������������Ķ������ؾ�����C2H4��ѡ���Ժʹ����ԡ�
��֪��ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת����
�ڱ�ʵ�������£�����C2H4�ĵ缫��ӦΪ______��
(3)��ʵ�������£���CO2ת��Ϊ����ת����Ϊ10%������C2H4��ѡ����Ϊ12%�����ռ���12 mol C2H4����ͨ���CO2Ϊ______mol��
����CO2��CH4�����������Ƶúϳ�����CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H
2CO(g)+2H2(g) ��H
(1)��֪����Ӧ1��CH4(g) �TC(s)+2H2(g) ��H1=+75kJmol��1
��Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1
H2O(g)+CO(g) ��H2=+35kJmol��1
��Ӧ3��2CO(g) �TC(s)+ CO2(g) ��H3=��172kJmol��1
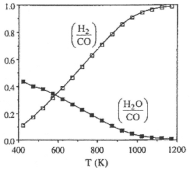
��ô�������Ӧ�ġ�H=___kJmol��1�����¶Ⱥ�ѹǿ�Ƕ����������CO2ƽ��ת���ʵ�������____��
(2)��ͼ��ʾ��ϵ��c(H2)/c(CO)��c(H2O)/c(CO)�ı仯����������1200K����c(H2)/c(CO)С��1��ԭ��___�����������¶ȵ�����c(H2)/c(CO)�����ԭ��____��
���𰸡�![]() ���CO2��Ũ�ȣ�����CO2�ķŵ�����������H+�ķŵ� 14CO2+12e-+8H2O= C2H4+12HCO3- 1000 +247 ���µ�ѹ ��Ϊ�����˷�Ӧ2 H2(g) + CO2(g)
���CO2��Ũ�ȣ�����CO2�ķŵ�����������H+�ķŵ� 14CO2+12e-+8H2O= C2H4+12HCO3- 1000 +247 ���µ�ѹ ��Ϊ�����˷�Ӧ2 H2(g) + CO2(g)![]() H2O(g) +CO(g) ���¶ȵ����ߣ�CH4(g)+CO2(g)
H2O(g) +CO(g) ���¶ȵ����ߣ�CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/ c(CO)��С�õ���֤���Ӷ�c(H2)/ c(CO)����
2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/ c(CO)��С�õ���֤���Ӷ�c(H2)/ c(CO)����
��������
��CO2�ǹ��ۻ�����������̼��ÿ����ԭ��֮����ڶ������õ��Ӷԣ�
��(1)����ͨ��CO2�����CO2�����Ũ�ȣ�ȷ��������������CO2�Ļ�ԭ��Ӧ��
(2) CO2�ڵ��ص������õ��ӷ�����ԭ��Ӧ����C2H4��
(3)��CO2ת��Ϊ����ת����Ϊ10%������C2H4��ѡ����Ϊ12%�����ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת��������μӷ�Ӧ��CO2�����ʵ�����
��(1)���ݸ�˹���ɼ�����H������¶Ⱥ�ѹǿ��ƽ���Ӱ�죬�����ٽ�ƽ�������ƶ���������
(2)����¶ȶԷ�Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1��CH4(g)+CO2(g)
H2O(g)+CO(g) ��H2=+35kJmol��1��CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H=+247 kJmol��1��ƽ��״̬��Ӱ�������
2CO(g)+2H2(g) ��H=+247 kJmol��1��ƽ��״̬��Ӱ�������
��CO2�ǹ��ۻ���������ʽΪ![]() ��
��
��(1)����ͨ��CO2��Ŀ����Ϊ�����CO2��Ũ�ȣ�����CO2�ķŵ�����������H+�ķŵ磬ȷ��������������CO2�Ļ�ԭ��Ӧ��
(2)CO2�ڵ��ص������õ��ӷ�����ԭ��Ӧ����C2H4�������ĵ缫��ӦΪ14CO2+12e-+8H2O=C2H4+12HCO3-��
(3)��μӷ�Ӧ��CO2�����ʵ���Ϊnmol������ѡ����=Ŀ����������ԭ����/ԭ���ܵ�ת������֪��12%=![]() ����ã�n=1000mol��
����ã�n=1000mol��
��(1)��֪����Ӧ1��CH4(g) �TC(s)+2H2(g) ��H1=+75kJmol��1����Ӧ3��2CO(g) �TC(s)+ CO2(g) ��H3=��172kJmol��1�����ݸ�˹���ɣ��ɷ�Ӧ1-��Ӧ3���ɵõ�CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)������H=(+75kJmol��1)-(��172kJmol��1)=+247 kJmol��1���Է�ӦCH4(g)+CO2(g)
2CO(g)+2H2(g)������H=(+75kJmol��1)-(��172kJmol��1)=+247 kJmol��1���Է�ӦCH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ��H=+247 kJmol��1�������¶Ⱥͽ���ѹǿ���ܴٽ�ƽ�������ƶ��������CO2ƽ��ת���ʵ������Ǹ��µ�ѹ��
2CO(g)+2H2(g) ��H=+247 kJmol��1�������¶Ⱥͽ���ѹǿ���ܴٽ�ƽ�������ƶ��������CO2ƽ��ת���ʵ������Ǹ��µ�ѹ��
(2)��Ӧ��ϵ�з����ķ�Ӧ2��H2(g) + CO2(g)![]() H2O(g)+CO(g) ��H2=+35kJmol��1���¶Ƚϵ�ʱ�����ڴ˷�Ӧ������У�ʹ��ϵ��c(H2)��Ũ�Ƚ��ͣ�
H2O(g)+CO(g) ��H2=+35kJmol��1���¶Ƚϵ�ʱ�����ڴ˷�Ӧ������У�ʹ��ϵ��c(H2)��Ũ�Ƚ��ͣ�![]() 2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/c(CO)��С�õ���֤���Ӷ�c(H2)/c(CO)����
2CO(g)+2H2(g) ��H>0��ƽ�����ƣ�COŨ��������CO2Ũ�Ƚ��ͣ���Ӧ2ƽ�����ƣ���ͼ��c(H2O)/c(CO)��С�õ���֤���Ӷ�c(H2)/c(CO)����


 ��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
��Ǭ����������ҵ���ּ����ӱ����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������İ���ͭ����![]() ������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
������ɱ�����ýȾ�����ڼ��Զ�ͭ��Ҳ���������Һ����Ҫ�ɷ֣��ڹ�ҵ����;�㷺�������¸���������ˮ���������Ҵ������ѣ��ڿ����в��ȶ�������ʱ�����ֽ⡣ij��ѧ��ȤС����Cu�ۡ�3mol/L�����ᡢŨ��ˮ��10% NaOH��Һ��95%���Ҵ���Һ��0.500 mol/Lϡ���ᡢ0.500 mol/L��NaOH��Һ���ϳ������İ���ͭ���岢�ⶨ�䴿�ȡ�
I��CuSO4��Һ���Ʊ�
�ٳ�ȡ4gͭ�ۣ���A����������10���Ӳ����Ͻ��裬������ȴ��
�����������м���30mL 3mol/L�����ᣬ��A�й��������������У����Ȳ����Ͻ��衣
�۳��ȹ��˵���ɫ��Һ��
(1)A����������Ϊ____��
(2)ijͬѧ��ʵ������1.5g��ͭ��ʣ�࣬��ͬѧ���Ƶõ�CuSO4��Һ������һ�������м���Ũ�����о�Ĥ���֣���ȴ�����ľ����к��а�ɫ��ĩ���Խ�����ԭ��_____
II��������Ʊ�
�������Ʊ���CuSO4��Һ����ͼ��ʾ���в���
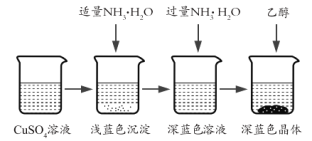
(3)��֪dz��ɫ�����ijɷ�Ϊ![]() ����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
����д�����ɴ˳��������ӷ�Ӧ����ʽ_________��
(4)��������ʱ���ü����Ҵ��ķ�����������Ũ���ᾧ��ԭ����__��
III���������IJⶨ
��ȷ��ȡmg���壬������ˮ�ܽ⣬ע����ͼ��ʾ������ƿ�У�Ȼ����μ���VmL10%NaOH��Һ��ͨ��ˮ����������ƷҺ�еİ�ȫ����������������ˮ��ϴ�����ڱڣ���V1mL C1mol/L���������Һ��ȫ���ա�ȡ�½���ƿ����C2mol/L NaOH����Һ�ζ���ʣ��HCl(ѡ�ü�����ָʾ��)�����յ�ʱ����V2mLNaOH��Һ��
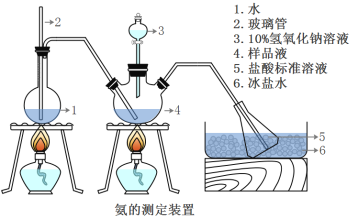
(5)Aװ���г������ܵ�����_____����Ʒ�а������������ı���ʽ_______��
(6)����ʵ���������ʹ�������ⶨ���ƫ�͵�ԭ����_______��
A���ζ�ʱδ��NaOH����Һ��ϴ�ζ���
B������ʱ���ζ�ǰƽ�ӣ��ζ�����
C���ζ�������ѡ�÷�̪��ָʾ��
D��ȡ�½���ƿǰ��δ������ˮ��ϴ�������ƿ�еĵ�����ڡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��ԭ��������������Ķ�����Ԫ�أ���X��Zԭ������֮����Y��Wԭ������֮�͵�1/2���ס��ҡ�������������ЩԪ����ɵĶ�Ԫ�����M��ij��Ԫ�ض�Ӧ�ĵ��ʣ��ҺͶ������Ԫ����ͬ��������һ������ɫ����������������N�Ǿ���Ư���Ե�����(������)���������ʼ��ת����ϵ��ͼ��ʾ(���ַ�Ӧ���������ʡ��)������˵����ȷ����
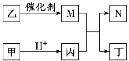
A. ԭ�Ӱ뾶��r(Y)>r(Z)>r(W)
B. ������N����ϩ����ʹ��ˮ��ɫ����ԭ����ͬ
C. ��WԪ�ص�����Һ���������ԡ����Ի����
D. Z��X��Y��W�γɵĻ������У���Ԫ�ؾ�����8���ӽṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ����Ļ�ѧ��Դ���⣬�����Ǻ�ˮ��Դ�ۺ����õIJ�������ͼ��

��1��������г�ȥ���������ʣ�Mg2����SO![]() ��Ca2�����������ҩƷ˳����ȷ����__________��
��Ca2�����������ҩƷ˳����ȷ����__________��
A. NaOH��Һ��Na2CO3��Һ��BaCl2��Һ�����˺������
B. BaCl2��Һ��NaOH��Һ��Na2CO3��Һ�����˺������
C. NaOH��Һ��BaCl2��Һ��Na2CO3��Һ�����˺������
D. BaCl2��Һ��Na2CO3��Һ��NaOH��Һ�����˺������
��2����������ѻ��Br2�������������SO2��ˮ��Һ��Br2���գ���Ŀ����___________��
��3��д��������з�����Ӧ�����ӷ���ʽ��_______________��
��4�����崵�뵽SO2��ˮ��Һ������X������������___������ţ���
A. ��ϩ B. ���� C. ��� D. CO2
��5���ɺ�ˮ��������еķ�Ӧ�ɵó�Cl����SO2��Br����ԭ��������ǿ��˳����___________��
��6�����Ǻ��ա������������ȷ���ı���ԭ�ϡ��������Ѳ���ǽ�����ǿ�ᷴӦ������ʱ��ȴ���볣���ķǽ������ʷ�Ӧ��Ŀǰ���ģ�����ѵķ����ǣ�TiO2��̿�ۻ�ϣ��ڸ���������ͨ��Cl2�Ƶ�TiCl4��һ�ֿ�ȼ�����塣�÷�Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��EPR����![]() ����PC������
����PC������ ���ĺϳ�·�����£�
���ĺϳ�·�����£�

��1��A�������� ___________��
��2��C�Ľṹ��ʽ____________��
��3������˵����ȷ���ǣ�ѡ����ĸ��_______________��
A. ��Ӧ���ԭ��������Ϊ100%
B. ��Ӧ��Ϊȡ����Ӧ
C. 1 mol E���������� Na ��Ӧ���������ɱ�״����22.4 L H2
D. CH3OH�ںϳ�PC���ϵĹ����п���ѭ������
��4����Ӧ��Ļ�ѧ����ʽ��_______________________________��
��5����Ӧ���Ļ�ѧ����ʽ��_______________________________��
��6����֪��

��D������Ϊ��ʼԭ�Ϻϳ�![]() ���Լ���ѡ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע����Ӧ�Լ�����������______________
���Լ���ѡ��д���ϳ�·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע����Ӧ�Լ�����������______________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�ֿɳ���-���������ͼ��ʾ������طŵ�ʱ��O2��Li+�ڶ��̼���ϵ缫������Li2O2-x��x=0��1��������˵����ȷ����

A. �ŵ�ʱ�����̼���ϵ缫Ϊ����
B. �ŵ�ʱ�����·�����ɶ��̼���ϵ缫����﮵缫
C. ���ʱ���������Һ��Li+����̼������Ǩ��
D. ���ʱ������ܷ�ӦΪLi2O2-x=2Li+��1��![]() ��O2
��O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Һ�ζ�δ֪Ũ�ȵ�NaOH��Һ�����и������л�����ʵ��������(����)
A. �ζ�ǰ��ʽ�ζ������������Һ��ϴ
B. ������ˮϴ����ƿ������װ��һ�������NaOH��Һ����еζ�
C. ��ʢ��20.00 mL NaOH��Һ����ƿ�У����뼸�η�ָ̪ʾ������еζ�
D. ������ˮϴ����ƿ������NaOH��Һ��ϴ��Ȼ��װ��һ�������NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ���Cl2 ��Na2O2 ��NaOH ��HCl ��H2O2 ��MgF2 ��NH4Cl
��1��ֻ�ɷǼ��Լ����ɵ�������___�����ţ���ͬ����
��2�������Ӽ��ͼ��Լ����ɵ�������___��
��3�����ڹ��ۻ������������___��
��4����H2O2�ĵ���ʽΪ��___��
��5���õ���ʽ��ʾ��MgF2���γɹ��̣�___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ����ȡ������Ϊ50mL��A��B����NaOH��Һ�У��ֱ�ͨ��һ������CO2����ϡ�͵�100mL����ϡ�ͺ����Һ����μ���0.1mol.L-1�����ᣬ����CO2���������״��������������������ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��

A.��NaOH��Һ��ͨ��һ������CO2����Һ�����ʵ���ɿ����Ǣ�NaOH��Na2CO3��Na2CO3��Na2CO3��NaHCO3��NaHCO3
B.B����˵����ԭ��Һͨ��CO2���������������ᷴӦ����CO2����������11.2L����״����
C.ԭNaOH��Һ�����ʵ���Ũ��Ϊ0.15mol/L
D.B���߱�����ԭ��Һͨ��CO2��������Һ�����ʵĻ�ѧʽΪNaOH��Na2CO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com