
����Ŀ���ش��������⣺
��1����̬Gaԭ�Ӽ۵����Ų�ͼΪ________��
��2�����ⶨ���֣�N2O5������NO2+��NO3-����������ɣ��ù�����Nԭ���ӻ�����Ϊ___;��NO2+��Ϊ�ȵ����������_____(д��һ��)��
��3���縺��:��_____��(����>������<��)����һ�������״������ԭ����________��
��4��NH3�����ڶ�������ʱH��N��H����Ϊ106.7������ͼ[Zn(NH3)6]2�����ӵIJ��ֽṹ�Լ�H��N��H���ǵIJ���ֵ�������������H��N��H���DZ�Ϊ109.5����ԭ��_______________________________��

��5����֪ͼ����������Ϊ[PtCl6]2-���ӣ�����ΪK+�������徧���߳�Ϊa pm��K2PtCl6�����ʽ��ΪM�������ӵ�������ֵΪNA�����ܶ�Ϊ________g��cm3���г�����ʽ���ɣ���

���𰸡�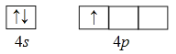 sp��sp2 SCN-��CO2��CS2��N3-���е���һ�� < ��ԭ��3p������ڰ����״̬��������ʧȥ���� ��������Zn2���γ������¶Ե�����Zn2���ɼ���ԭ�¶Ե�������Ե��Ӽ���ų����ñ�Ϊ���Ե��Ӽ���ų⣬�ų��������H��N��H���DZ�� 4��1030M/(a3 NA)
sp��sp2 SCN-��CO2��CS2��N3-���е���һ�� < ��ԭ��3p������ڰ����״̬��������ʧȥ���� ��������Zn2���γ������¶Ե�����Zn2���ɼ���ԭ�¶Ե�������Ե��Ӽ���ų����ñ�Ϊ���Ե��Ӽ���ų⣬�ų��������H��N��H���DZ�� 4��1030M/(a3 NA)
��������
��1����̬Gaԭ�Ӽ۵���4s24p1���ɴ�д���۵����Ų�ͼ ��
��
��2��NO2����Nԭ�Ӽ۲���ӶԸ���=2+��5-1-2��2��/2=2��NO3����Nԭ�Ӽ۲���ӶԸ���=3+(5+1-2��3)/2=3�����ݼ۲���ӶԻ��������ж�Nԭ���ӻ����ͣ���NO2����Ϊ�ȵ���������к���3��ԭ�ӡ��۵�������16��
��3��ͬһ����Ԫ�أ�Ԫ�صĵ縺������ԭ����������Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ�
��4����������Zn2���γ������¶Ե�����Zn2���ɼ���ԭ�¶Ե�������Ե��Ӽ���ų����ñ�Ϊ���Ե��Ӽ���ų⣬�ų��������H��N��H���DZ��
��5���ɾ�̯������Ϧ�=m/V���㡣
��1����̬Gaԭ�Ӽ۵���4s24p1���ɴ�д���۵����Ų�ͼ�� ��
��
��2��NO2����Nԭ�Ӽ۲���ӶԸ���=2+��5-1-2��2��/2=2��NO3����Nԭ�Ӽ۲���ӶԸ���=3+(5+1-2��3)/2=3�����ݼ۲���ӶԻ��������ж�Nԭ���ӻ����ͣ�ǰ����sp�ӻ���������sp2����NO2����Ϊ�ȵ���������к���3��ԭ�ӡ��۵�������16��������ӻ�Ϊ�ȵ��������SCN����CO2��CS2��N3�����е���һ�֣�
��3��ͬһ����Ԫ�أ�Ԫ�صĵ縺������ԭ���������縺��:��<��Ԫ�ص�һ����������ԭ��������������������ƣ�����IIA�塢��VA��Ԫ�ص�һ�����ܴ���������Ԫ�أ���һ�������״������ԭ���ǣ���ԭ��3p������ڰ����״̬��������ʧȥ���ӣ�
��4����������Zn2���γ������¶Ե�����Zn2���ɼ���ԭ�¶Ե�������Ե��Ӽ���ų����ñ�Ϊ���Ե��Ӽ���ų⣬�ų��������H��N��H���DZ��
��5�������߳�Ϊapm=a��10-10cm���������=��a��10-10cm��3���þ����а���K+����Ϊ8��[PtCl6]2-���Ӹ���Ϊ8��1/8+6��1/2=4���侧���ܶ�=m/V=4M/[��a��10-10cm��3NA]=4��1030M/(a3 NA)g��cm��3.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����
A. ����ˮ�����ɵ������л��ﻥΪͬ���칹��
B. ����5��̼ԭ�ӵı�����������һ�ȴ�����3��
C. �����������ڹ����·�����Ӧ�IJ��������10��
D. �����ĽṹΪ![]() �����Ķ��Ȼ���������(�����������칹)
�����Ķ��Ȼ���������(�����������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X��Y��Z��W��4��ԭ��������������Ķ�����Ԫ�أ�����Xԭ����Ԫ�����ڱ���ԭ�Ӱ뾶��С��Y��Zλ��ͬһ���壬Yԭ�ӵ�����������������Ӳ�����3��������˵����ȷ����
A. Ԫ�طǽ����ԣ�Z B. ԭ�Ӱ뾶��W>Z>Y
C. 0.1mol/L��ҺpH��X2Z D. Z2W2�и�ԭ�Ӷ��ﵽ�ȶ��ṹ�������ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪MOHΪһԪ���25��ʱ�����볣��Kb=1��10�� 6 mol��L��1��25��ʱ��0.01 mol��L��1 MOH��Һ��pH=10������������pH=4��������Һ��ϣ�������Һ��pH_____7���>������<����=�����������ʱ��Һ��MCl��ˮ��ƽ�ⳣ��Kh=__________mol/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���Ա��Ϊ�������õ�ⷨ�����̵����е�NO������ת��ΪNH4NO3��ԭ������ͼ��ʾ������˵���������

A. �õ��ص�������ӦΪ��NO - 3e- + 2H2O = NO3- + 4H+
B. Ϊʹ������ȫ��ת��ΪNH4NO3���貹������AΪHNO3
C. �õ��صĵ缫����Ϊ���ʯī��Ŀ�������NO�������ʺͼӿ췴Ӧ����
D. ��NH4NO3��ϡ��Һ����ˮ������ǿ���������������ڵ���˳������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ������һ����Ҫ�Ļ���ԭ�ϣ��������Ʊ���˾ƥ�֡�ˮ�����ơ�ˮ�������Ͱ�ɳ����ơ����а�ɳ����������������Խ᳦�ij���ҩ���ϳ�·��������ʾ���ش��������⣺

��֪��
I�� 
II��
III��NaNO2��ǿ�����ԡ�
�ش��������⣺
��1���л���A�еĹ���������Ϊ________________����ɳ������ں˴Ź��������е����շ�ķ����֮��Ϊ__________��
��2����Ӧ�ڵķ�Ӧ����Ϊ____________����Ӧ�۵ķ���ʽΪ______________________����Ӧ�ܵķ�Ӧ����Ϊ____________��
��3������Һ�з�Ӧ�����õ��Լ�XΪ___________��
��4�����B��C�����Ŀ��Ϊ______________________��
��5��ˮ�����ж���ͬ���칹�壬д��������������������ͬ���칹���Ľṹ��ʽ��
a���ܷ���������Ӧ b�������ϵ�һ�ȴ���������ͬ���칹��___________________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬ��ͬѹ�£�a g����A��b g����B�ķ�������ͬ������˵���в���ȷ����(����)
A. A��B�����������Է�������֮��Ϊa��b
B. ��ͬ��ͬѹ�������£�A��B����������ܶ�֮��Ϊb��a
C. ͬ������A��B��������ķ��Ӹ���֮��Ϊb��a
D. ��ͬ�����£�ͬ���A������B���������֮��Ϊa��b
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��;�㷺����ҵ�Ͽ�ͨ���������̺ϳɶ��ʴ������������֪��R-OH + SOCl2 �� R-Cl + SO2 ��+ HCl�� ��ش�

��1��д��B�Ĺ����ŵĵ���ʽ________________________��
��2��д���й����ʵĽṹ��ʽ��A_________________��_________________��
��3��ָ����Ӧ���ͣ���_________________��
��4��д�����л�ѧ����ʽ����Ӧ��______________����Ӧ��___________��
��5���ٶ��ʴ������������Ҷ����ѣ�������ṹ�ж�����˵����ȷ����____(�����)��
a. ������ˮ b. �е�ϸ� c. ����ȼ��
��E��ͬ���칹��ܶ࣬д�������ܹ�����������Ӧ�������칹��Ľṹ��ʽ_________________��
(6)��д����1-�ȱ���ϳɱ�ͪ�ĺϳ�·��ͼ��ע����Ӧ����(���Լ���ѡ)________���ϳ�·������ͼʾ�����£�CH3CH2OH![]() CH2��CH2
CH2��CH2![]() Br��CH2CH2��Br
Br��CH2CH2��Br
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״����V L�����ܽ���1Lˮ�У�ˮ���ܶȽ���Ϊ1g��mL-1����������Һ���ܶ�Ϊ�� g��mL-1����������Ϊ�������ʵ���Ũ��Ϊc mol��L-1�������й�ϵ�в���ȷ���ǣ� ��
A. ��=![]() B. ��=
B. ��=![]()
C. ��=![]() D. c=
D. c=![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com